8月文献导读目录
1. Immunity | 多组学分析显示硒在控制克罗恩病T细胞分化中起着关键作用
2. Nature | 膳食果糖改善肠道细胞存活和营养吸收
3. Cell Host & Microbe | 一种微生物来源胆汁酸通过NR4A1增强Treg分化
4. Cell Metabolism | 白血病发生对丙酮酸脱氢酶的需求取决于细胞谱系
5. Nature Communications | Anaerostipes菌将肌醇转化为SCFA,或有益健康
6. Nature Reviews | 治疗抵抗和肥胖背景下的肿瘤脂肪酸代谢
7. Cell | 多胺:辅助性T细胞命运的代谢指南针
8. Nature Communications | 谷氨酰胺通过两条平行通路调控谷氨酰胺凋亡
9. Cell Reports | lncRNA Tug1的肾脏保护作用需要PGC1α,并与尿素循环代谢物相关
10. Science | 高脂饮食诱导结肠细胞功能障碍加速菌群衍生物TMAO生成
11. Gut | 综合代谢组学特征揭示门静脉血清代谢组的改变诱发肝细胞癌HCC
一、Immunity | 多组学分析显示硒在控制克罗恩病T细胞分化中起着关键作用

炎症性肠病 (IBD)是现代社会常见的消化系统疾病,T细胞的功能失衡是IBD重要的致病因素,同时低水平的硒与IBD的发病密切相关,但硒蛋白如何调控IBD炎症状态下的T细胞功能仍有待探索。本研究团队利用多组学结合体内外研究证实硒元素主要通过硒蛋白W (SELW) 调控一碳代谢和嘌呤补救途径介导活性氧 (ROS) 清除,从而影响Th1细胞的分化。
(1) 首先,在初诊未治疗克罗恩病 (CD) 和溃疡性结肠炎 (UC)患者肠道活检组织进行单细胞转录组测序,发现CD患者结肠中存在类似Th1 (Th1-like) 的细胞,而UC患者中存在Th17样细胞 (Th17-like),发现这两个T细胞亚群的存在多个代谢酶表达差异;
(2) 该研究团队进一步对健康志愿者、活动期CD和UC患者结肠组织进行非靶向代谢组检测,分别鉴定出在CD和UC中特异性变化的代谢物,包括可以调控特定疾病亚型中T细胞亚群分化的代谢物(见图)。含硒代谢物在CD病人的结肠组织中特异性下调,患者血清中硒水平也与疾病的活动度呈负相关;
(3) 体外分化实验显示,补充硒可以明显抑制Th1的分化,通过转录组、代谢组、代谢流、流式等技术对h1细胞进行了分析,发现硒处理后Th1细胞中嘌呤合成补救途径中的酶及代谢物显著升高,一碳代谢叶酸循环显著下调。通过硒蛋白W调控一碳代谢和嘌呤补救途径介导细胞质中的活性氧(ROS) 清除,从而影响NF-κB信号通路的活化,抑制IFN-γ的产生;
(4) 在缺硒小鼠中建立T细胞过继转移肠炎模型,发现补充硒制剂后可以显著减轻肠炎症状,减少结肠固有层中的Th1细胞。临床研究结果也显示补充硒可以促进缺硒克罗恩病患者症状的改善和结肠黏膜的愈合。
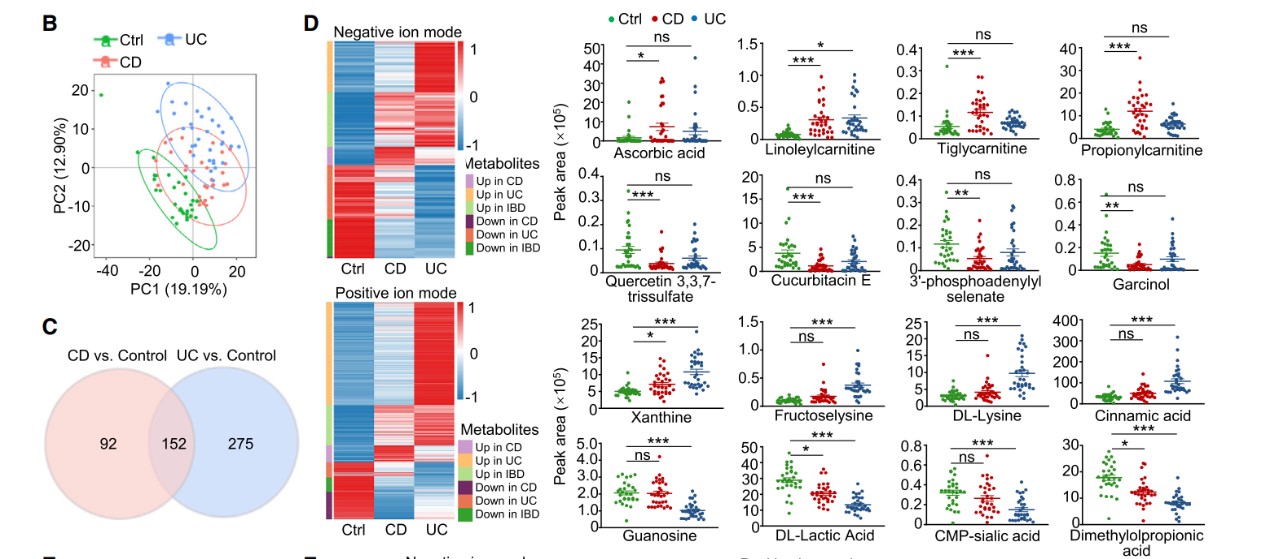
Multiomics analyses reveal a critical role of selenium in controlling T cell differentiation in Crohn’s disease. Immunity. https://doi.org/10.1016/j.immuni.2021.07.0
原文阅读,请长按识别下方二维码

二、Nature | 膳食果糖改善肠道细胞存活和营养吸收

随着现代农业和工业的发展,普遍使用的甜味剂将果糖的总消费量增加了两倍,并导致肥胖和代谢性相关疾病的迅速流行。有研究表明果糖摄入量与结直肠癌的发病存在因果关系。摄入果糖对肠道细胞的影响尚不清楚。本研究发现果糖衍生的 F1P 抑制 PKM2,可促进肠道中缺氧细胞的存活,增加肠绒毛长度,肠道表面积扩大,从而促进了营养吸收。
(1) 给予小鼠高果糖玉米糖浆(HFCS)喂食四个星期,并使用高通量、基于图像分割的方法量化平均肠绒毛长度。结果表明,与对照处理的小鼠相比,HFCS 处理小鼠的十二指肠和近端空肠中的肠绒毛长度增加了 25-40%。绒毛长度的增加与体重增加、脂肪积累以及脂质吸收的增加相关;
(2) 三组小鼠分别接受果糖处理及未处理的不同热量食物。发现食用果糖的小鼠体重和脂肪量明显高于食用蔗糖/葡萄糖的小鼠。膳食果糖可增加肠绒毛长度和促进营养吸收。细胞存活是果糖处理条件下绒毛肥大的主要决定因素;
(3) 构建了缺失 PKM2 活性的 HCT116 细胞,使用 shRNA 敲低了 PKM2 mRNA 的表达,并在存在或不存在果糖的情况下将这些细胞暴露于缺氧环境。在 PKM2 受到抑制的情况下,果糖不再改善缺氧细胞的存活;
(4) 当使用 TEPP-46 激活细胞中的 PKM2 时,果糖的作用大大减弱,表明 PKM2 是果糖诱导的细胞存活的关键介质。通过小肠上皮细胞特异性 PKM2 缺失性小鼠验证了果糖调节肠道上皮细胞存活的生理学功能。
Taylor, S.R., Ramsamooj, S., Liang, R.J. et al. Dietary fructose improves intestinal cell survival and nutrient absorption. Nature (2021). https://doi.org/10.1038/s41586-021-03827-2.
原文阅读,请长按识别下方二维码

三、Cell Host & Microbe | 一种微生物来源胆汁酸通过NR4A1增强Treg分化

美国哈佛医学院研究团队先后在Nature上在线发表《Microbial bile acid metabolites modulate gut RORγ+ regulatory T cell homeostasis》、《Bile acid metabolites control TH17 and Treg cell differentiation》研究成果。研究发现饮食及微生物因素均可控制肠道胆汁酸代谢物合成,进而调控TH17和Treg细胞(RORγ+ Tregs),从而调控宿主免疫。而本研究从3-氧石胆酸(3-oxoLCA)转化成异别石胆酸(isoalloLCA)肠道细菌、isoalloLCA调控必要条件、isoalloLCA及其合成基因水平在炎症性肠病患者变化情况等方面进行了研究。
(1) 临床粪便中分离出990种肠道菌群分别与LCA或3-oxoLCA进行共培养,未发现将LCA代谢成isoalloLCA的相关菌种,但筛选到16个细菌菌种可将3-oxoLCA代谢成isoalloLCA,全部来自拟杆菌门。此外,isoalloLCA水平受到不同菌种之间协同代谢调控;
(2) 3-oxoLCA通过5β-还原酶、5α-还原酶和3β-HSDH活性转化为isoalloLCA,并寻找到可编码三种酶的同系物的可诱导基因簇;
(3) isoalloLCA对iTreg分化调控依赖于转录因子NR4A1,NR4A1可通过CNS3依赖方式刺激Foxp3转录,从而直接参与iTreg分化;
(4) 临床上,与对照组相比,IBD(包括CD和UC)患者样本中isoalloLCA及其生物合成基因水平不仅普遍降低,甚至大部分患者样本中未被检测到。说明isoalloLCA及其生物合成基因水平与IB。D病理情况存在负相关。
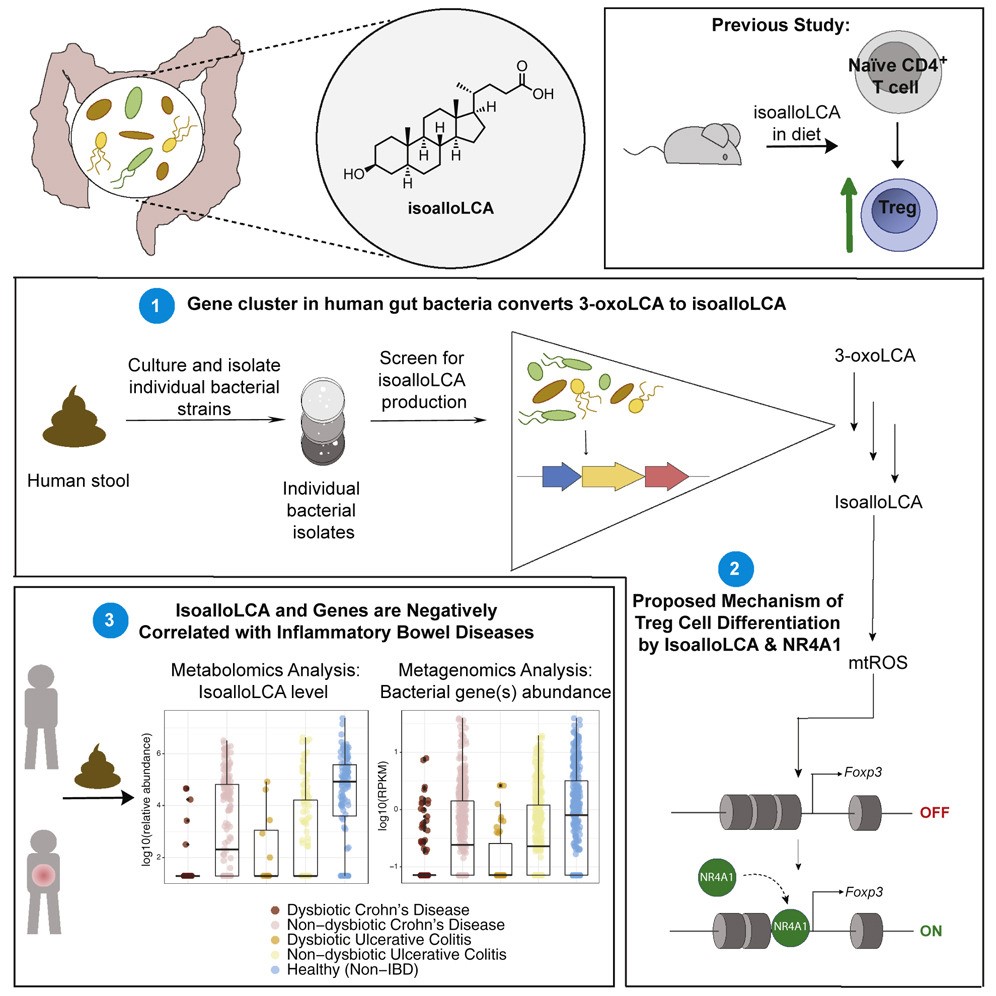
A bacterial bile acid metabolite modulates Treg activity through the nuclear hormone receptor NR4A1. Cell Host & Microbe. 2021. DOI:https://doi.org/10.1016/j.chom.2021.07.013.
原文阅读,请长按识别下方二维码

四、 Cell Metabolism | 白血病发生对丙酮酸脱氢酶的需求取决于细胞谱系

癌细胞在代谢上与其相应的正常组织相似。癌症和正常组织之间的差异可能反映了在转化或维持引发癌症的特定正常细胞类型的代谢过程中的重编程。美国德克萨斯大学西南医学中心Michalis Agathocleous课题组揭示了糖代谢在造血发育以及白血病发生过程中的组织特异性,发现了糖酵解到TCA循环的关键酶-丙酮酸脱氢酶(PDH)在CD4+CD8+双阳性T细胞发育及T细胞白血病中的重要作用。
(1) 给小鼠注射荧光标记的葡萄糖(glucose)类似物2-NBDG或者同位素标记的U13C-glucose,收集不同种类的血液细胞进行代谢组学分析。结果显示与其他造血细胞相比,CD8+T细胞是骨髓中糖酵解最活跃的细胞类型;
(2) PDH是丙酮酸生成乙酰辅酶A(acetyl-CoA)的关键酶,acetyl-CoA是glucose进入TCA循环的连接点。PDH的E1α亚单位(Pdha1)的敲除特异性地减少了CD4+CD8+-双阳性(DP)胸腺细胞及其后代的数量,但不影响大多数其他造血细胞类型;
(3) PTEN(抑癌基因)的敲除可以同时诱发小鼠急性T淋巴细胞性白血病(T-ALLs)、骨髓增殖性肿瘤(MPNs)和急性骨髓性白血病(AML),敲除Pdha1可通过抑制细胞增殖和促进凋亡来抑制Pten(抑癌基因)缺失小鼠T细胞白血病的发生,却无法阻碍小鼠髓系白血病的发展;
(4) 代谢组学分析证实Pdha1敲除影响了胸腺细胞中糖酵解到TCA循环的过渡,胸腺中丙酮酸水平升高,柠檬酸水平降低。另外,Pdha1敲除还影响了胸腺的氧化还原稳态,敲除细胞表现出较高的NAD+/NADH水平,谷氨酸和谷胱甘肽的产生受到了抑制。
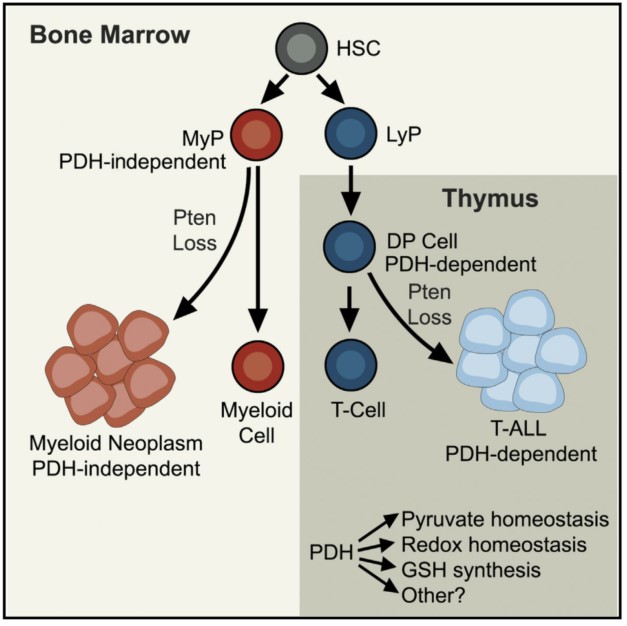
The requirement for pyruvate dehydrogenase in leukemogenesis depends on cell lineage. Cell Metabolism. doi: 10.1016/j.cmet.2021.07.016.
原文阅读,请长按识别下方二维码

五、Nature Communications | Anaerostipes菌将肌醇转化为SCFA,或有益健康

肠道菌群代谢产生的短链脂肪酸(SCFA)在维持肠道稳态中发挥重要作用,如乙酸可以调控体重和胰岛素敏感性,丙酸盐和丁酸盐则参与很多信号的转导过程。肌醇是一种六碳环醇,有研究发现口服肌醇或其异构体,可以有效改善2型糖尿病在内的代谢性疾病的胰岛素的敏感性,但其发挥作用的机制尚不明确。荷兰的Willem M. deVos研究团队发现,部分Anaerostipes菌属的菌株可以将膳食肌醇代谢为丙酸盐和丁酸盐等SCFA,提示肌醇可能通过这种途径调节机体的肠道稳态和代谢通路。同时Anaerostipes.spp可能作为益生菌用于维护机体的健康。
(1) 在体外厌氧条件下Anaerostipes.spp部分菌株可将肌醇代谢产生丙酸、丁酸等短链脂肪酸(SCFAs),其中A. rhamnosivorans DSM26241T和A. caccae DSM14662T均能快速代谢肌醇;
(2) A. rhamnosivorans生长在含有 [13C6] 肌醇、[4-13C] 肌醇或 [4,5-13C2] 肌醇作为能量和碳源的碳酸氢盐缓冲培养基中。结合NMR和质谱方法构建了Anaerostipes代谢肌醇的通路;
(3) 基于NMR和质谱数据,本研究重建了整个肌醇代谢途径,并结合蛋白质基因组学和酶分析进一步研究揭示A.rhamnosivorans中存在肌醇代谢途径完整的酶和基因簇;
(4) 13C示踪后用NMR 分析末端代谢物,结果显示人肠道六磷酸肌醇可以代谢产生丙酸和丁酸等SCFAs;
(5) 肌醇代谢相关基因簇与糖尿病人群中代谢标志物呈负相关,肌醇和A.rhamnosivorans共同给药可显著降低空腹血糖。
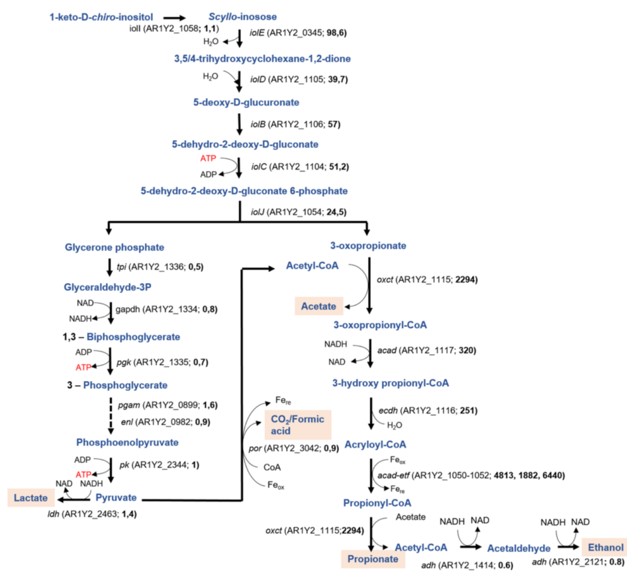
Conversion of dietary inositol into propionate and acetate by commensal Anaerostipes associates with host health. Nature Communications. doi: 10.1038/s41467-021-25081-w.
原文阅读,请长按识别下方二维码

六、Nature Reviews | 治疗抵抗和肥胖背景下的肿瘤脂肪酸代谢
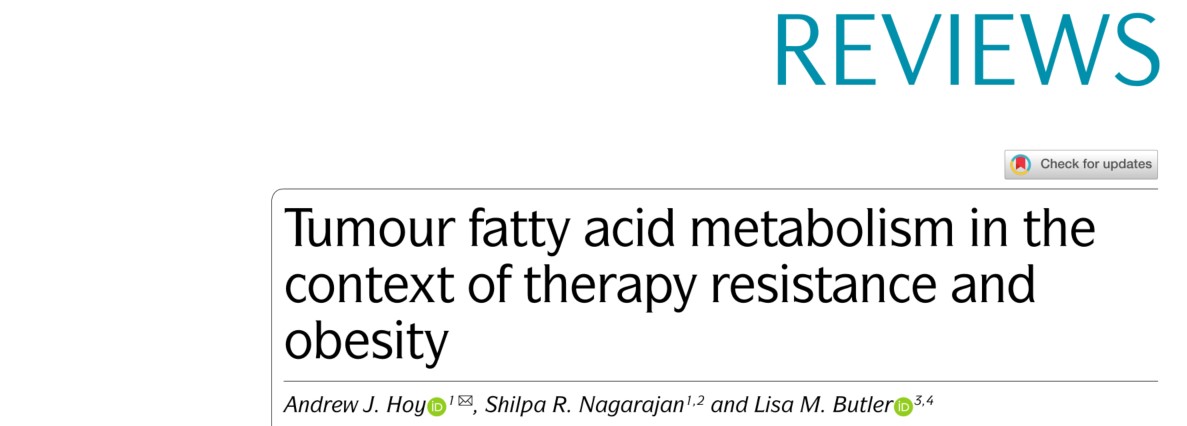
已知脂肪酸代谢通过增强脂质合成、储存和分解代谢支持肿瘤发生和疾病进展以及治疗抵抗。最近,膜脂肪酸组成(例如饱和、单不饱和和多不饱和脂肪酸的比率)在促进细胞存活的同时限制脂肪毒性和铁死亡方面的作用越来越受到重视。并且肿瘤细胞在脂肪酸代谢方面表现出可塑性,对肿瘤外和全身代谢信号(如肥胖和癌症治疗)作出反应,从而促进侵袭性、抗治疗性疾病的发展。本研究描述了与治疗抵抗有关的细胞脂肪酸代谢变化,并将宿主脂肪酸代谢中与肥胖相关的变化联系起来,这些变化可能影响局部肿瘤微环境,从而进一步改变癌细胞行为,同时产生潜在的新脆弱性。
(1) 癌细胞膜的特征是单不饱和脂肪酰基 (MUFA) 侧链与饱和脂肪酰基 (SFA) 侧链以及 MUFA与多不饱和脂肪酰基(PUFA)的比率增加,从而导致脂毒性和铁死亡敏感性降低;
(2) 在不同癌症或治疗环境中,基于代谢的抗治疗细胞的共同特征包括增加脂滴(LD)数量和大小,增加LD和线粒体接触,促进脂肪酸(FA)氧化增加,增加乙酰辅酶A羧化酶(ACC)和FASN催化的从头FA合成,这些都与FA代谢相关基因的表达改变有关;
(3) 许多癌症类型的风险和癌症相关死亡率在肥胖人群中发生改变。脂肪细胞可以影响体外癌细胞的行为,而脂肪细胞的脂解作用是脂肪细胞介导的乳腺癌细胞增殖所必需的。脂肪细胞促生长作用所需的一系列脂肪酸摄取相关蛋白水平的增加促进了脂肪细胞衍生脂肪酸在癌细胞中的积累。
Tumour fatty acid metabolism in the context of therapy resistance and obesity. Nature Reviews Cancer. doi: 10.1038/s41568-021-00388-4.
原文阅读,请长按识别下方二维码

七、Cell | 多胺:辅助性T细胞命运的代谢指南针

代谢重编程和表观遗传重塑之间的相互作用可能是调控细胞命运的关键。本文利用代谢组学、统计学和遗传学方法全面阐述了多胺代谢指导辅性T细胞(TH)谱系选择、表观遗传状态和炎症中的致病潜力。
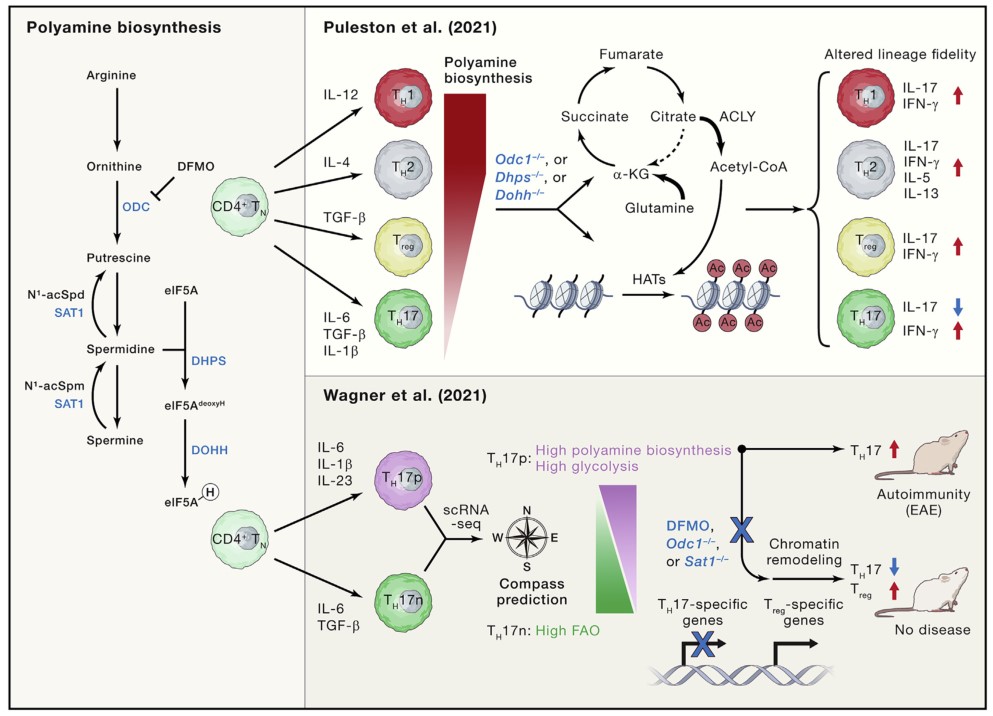
(1) 多胺代谢在辅性T细胞(TH)命运中的核心作用:使用遗传学方法,Puleston 等发现多胺-亚精氨酸轴通过表观基因组之间的相互作用和三羧酸 (TCA) 循环的重塑来增强TH细胞亚组的保真度;
(2) 确定了TH细胞亚群中多胺生物合成的动态调节,揭示了鸟氨酸脱羧酶(ODC,由 Odc1 编码)的差异表达,它是将精氨酸衍生的鸟氨酸转化为腐胺的限速酶,在TH细胞亚群中,TH1 和TH2 细胞表达的水平高于调节性 T细胞(Treg)和TH17 细胞;
(3) 应用遗传方法确定了多胺代谢的功能重要性,Odc1 基因缺失导致体外TH细胞分化程序失调,这与谱系特异性转录因子和细胞因子的异常表达相关。此外,Odc1 缺失的 CD4+T 细胞在诱导结肠炎方面具有很高的致病性,并能促进TH1分化,但在转移到免疫缺陷小鼠后会损害TH17 细胞分化,这突出了体内TH 细胞亚群中多胺从头合成的不同需求;
(4) 开发了一种名为 Compass 的新型计算工具,通过利用 scRNA-seq 和通量平衡分析在单细胞水平上预测特定反应的代谢通量;
(5) 建立了多胺代谢的动态调节机制,多胺生物合成的化学和遗传抑制导致TH17p 和TH17n 条件下TH17 细胞因子减少,并相应激活 Treg细胞相关转录因子 Foxp3。
Polyamine: A metabolic compass for T helper cell fate direction. Cell. 2021. https://doi.org/10.1016/j.cell.2021.07.012.
原文阅读,请长按识别下方二维码

八、Nature Communications | 谷氨酰胺通过两条平行通路调控谷氨酰胺凋亡

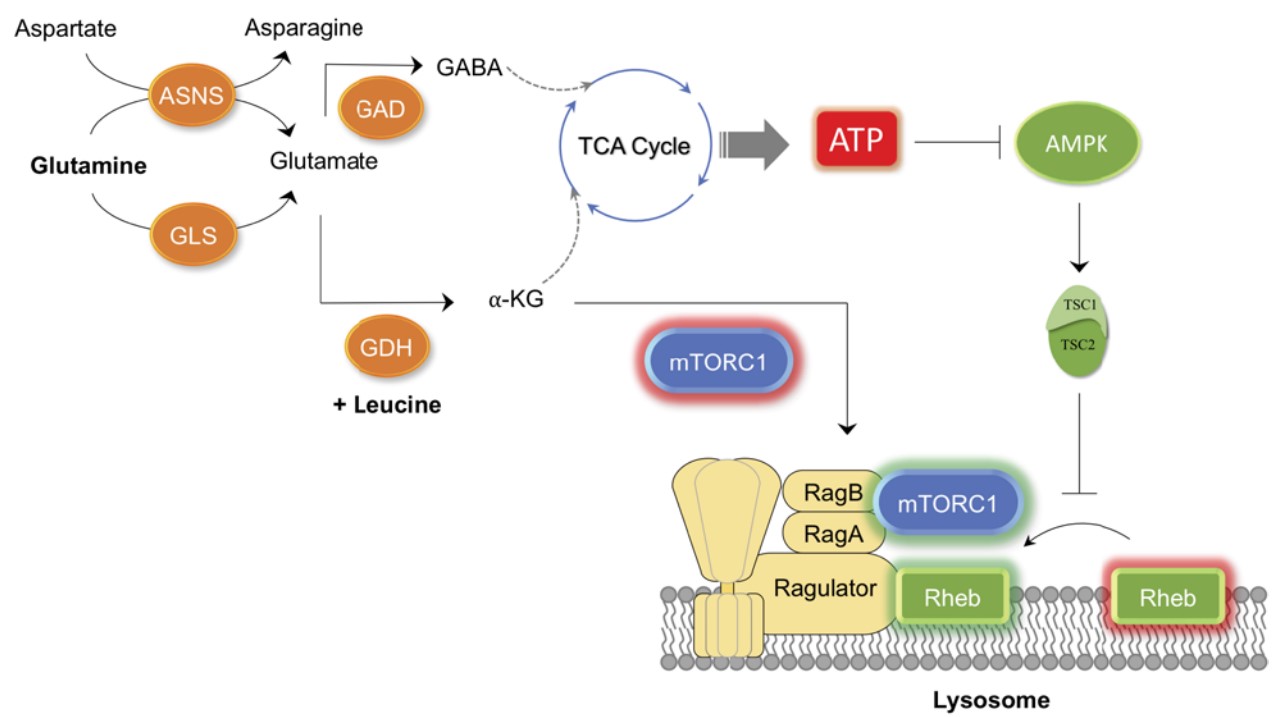
谷氨酰胺凋亡是增殖细胞营养失衡期间谷氨酰胺分解和 mTORC1 信号传导异常激活的结果,诱导细胞凋亡。生物能传感器 AMPK 在谷氨酰胺凋亡过程中的作用尚未确定。本研究揭示了谷氨酰胺代谢通过两条平行途径与 mTORC1 激活相关:α-酮戊二酸(αKG)依赖的途径;和ATP/AMPK依赖途径。
(1) 谷氨酰胺水解维持 ATP 的产生以抑制 AMPK 并激活 mTORC1。即使在没有任何其他氨基酸的情况下,长期的谷氨酰胺分解也足以增加细胞的呼吸能力和 ATP 的产生。AMPK 抑制是体外和体内谷氨酰胺凋亡所必需的;
(2) 添加亮氨酸和谷氨酰胺(LQ 处理)到缺乏氨基酸的细胞中足以激活谷氨酰胺分解,谷氨酰胺酶GLS 和谷氨酸脱氢酶GDH的抑制并未阻碍LQ处理的细胞中的ATP 的产生,表明LQ 介导的 ATP 生产不需要谷氨酰胺分解;
(3) 用谷氨酰胺或分别处理氨基酸饥饿的 U2OS、HCT116 和 HEK293A 细胞,检测 ATP 水平,结果显示,与亮氨酸不同,单独的谷氨酰胺足以维持所有三种细胞系中的 ATP 水平,但谷氨酰胺不足以激活 mTORC1;
(4) 谷氨酰胺分解是产生 αKG 和在溶酶体表面诱导 mTORC1 易位所必需的。同时,谷氨酰胺维持 ATP 的产生和 AMPK 的抑制,不依赖GLS 和 GDH,这是在溶酶体表面完全激活 mTORC1 所必需的;
(5) 天冬酰胺合成酶ASNS 参与代谢途径,替代谷氨酰胺分解,在没有亮氨酸的情况下代谢谷氨酰胺。单独GLS敲低和 ASNS 敲低都无法抑制 mTORC1 活性,而 GLS和ASNS 都敲低的双重抑制后,显著抑制mTORC1 活性。
Two parallel pathways connect glutamine metabolism and mTORC1 activity to regulate glutamoptosis. Nature Communications. 2021. https://doi.org/ 10.1038/s41467-021-25079-4.
原文阅读,请长按识别下方二维码

九、Cell Reports | lncRNA Tug1的肾脏保护作用需要PGC1α,并与尿素循环代谢物相关

lncRNA牛磺酸上调基因1(Tug1)是糖尿病肾病(DN)进展中一个有前景的治疗靶点,但其保护的分子基础仍然知之甚少。本研究揭示过氧化物酶体增殖物激活受体γ辅激活子1α(PGC1α)是Tug1的肾脏保护作用所必需的,Tug1-PGC1α轴对糖尿病实验模型中线粒体代谢稳态和尿素循环代谢物的功能作用,为靶向糖尿病肾病(DN) 患者的 lncRNA Tug1 来调控尿素循环中间体的治疗策略提供理论依据。
(1) 构建转基因小鼠模型,其中 Tug1 的过表达与糖尿病 db/db 小鼠足细胞中 PGC1α 的条件性缺失相结合,结果表明,PGC1α 敲除逆转Tug1 过表达的保护表型,表明 PGC1α 是 Tug1 的肾脏保护作用所必需的;
(2) 转录组学结果显示,与对照组相比,Tug1 敲低 (shTug1)的足细胞组中糖酵解相关基因(Aldh2、Pck2、Pfkl、Pgam1、Pgk1 和 Bpgm)的 mRNA 水平增加了 2 倍以上,而OXPHOS 相关基因显著降低,包括 TCA 酶Ogdh和线粒体呼吸链复合体 I、II、III 和 IV。这表明 Tug1敲除细胞中糖酵解增强和OXPHOS活性降低;
(3) 代谢组学结果显示,尿素循环的中间体鸟氨酸和瓜氨酸被 Tug-KD 和 Tug1-KD/Pgc1OE 细胞系改变最显著;检测尿素循环关键酶,发现Tug1-KD 细胞中 ARG2 表达高,且Arg2 启动子驱动的荧光素酶活性被 Tug1 和 PGC1α 以剂量依赖性方式显著抑制,表明 Tug1 和 PGC1α 可以负调节 Arg2 的转录。总之,改变的尿素循环代谢物和线粒体精氨酸酶 2 在 Tug1/PGC1α 诱导的线粒体重塑中发挥重要作用。
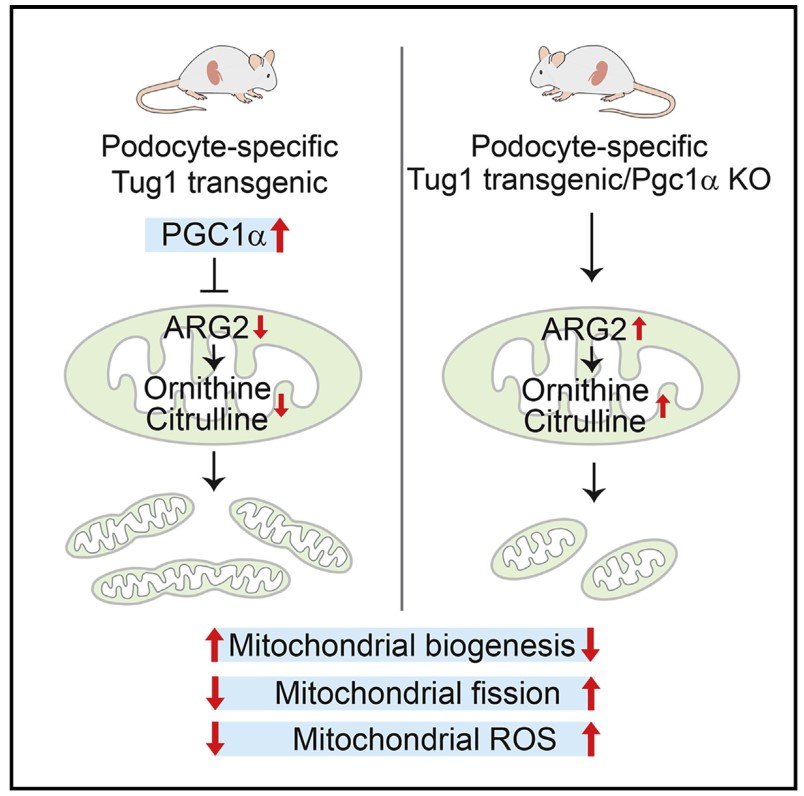
PGC1α is required for the renoprotective effect of lncRNA Tug1 in vivo and links Tug1 with urea cycle metabolites. Cell Reports. 2021. https://doi.org/10.1016/j.celrep.2021.109510.
原文下载,请长按识别下方二维码

十、 Science | 高脂饮食诱导结肠细胞功能障碍加速菌群衍生物TMAO生成

西式高脂肪饮食或因富含胆碱会被肠道微生物转化为三甲胺(TMA)从而导致心血管疾病,但饮食引起的肠道生理变化是否能改变微生物群的代谢能力尚不清楚。本文通过饮食诱导的肥胖小鼠模型,发现长期暴露于高脂肪饮食通过改变肠道上皮生理机制,从而增强大肠杆菌的呼吸依赖性胆碱分解代谢,导致循环中三甲胺-N-氧化物(TMAO)的水平增加,而TMAO与动脉硬化和全因死亡风险相关。
(1) 首先使用C57BL/6J小鼠在低或高脂肪饮食中添加E.coli Nissle 1917(肠杆菌科),发现高脂组中粪便大肠杆菌携带量显著增加,高脂肪饮食与低度黏膜炎症和与上皮细胞线粒体活性降低相关,且高脂肪摄入可以消除上皮细胞缺氧,增加肠腔内氧气生物利用度;
(2) 高脂肪饮食通过宿主源性呼吸电子受体(如氧气和**盐)的生物利用度增加诱导大肠杆菌丰度升高,宿主**盐腔内浓度的增加将导致大肠杆菌菌株MS 200-1在消化道内胆碱分解代谢升高,但氨基胍盐酸盐(AG)处理可消除**盐的浓度和cutC介导的胆碱利用促进大肠杆菌生长,表明高脂饲粮通过提高宿主**盐的利用率来增强胆碱分解代谢;
(3) 大肠杆菌MS 200-1野生型相关的小鼠血浆中TMAO水平显著增加,表明高脂饮食通过支持细菌呼吸来增加大肠杆菌胆碱分解代谢,AG 处理对宿主 iNOS 活性的抑制减弱了大肠杆菌 MS 200-1 在补充胆碱的高脂肪饮食的小鼠中生长并降低循环 TMAO 水平,用5-氨基水杨酸处理可减弱循环TMAO水平的增加。
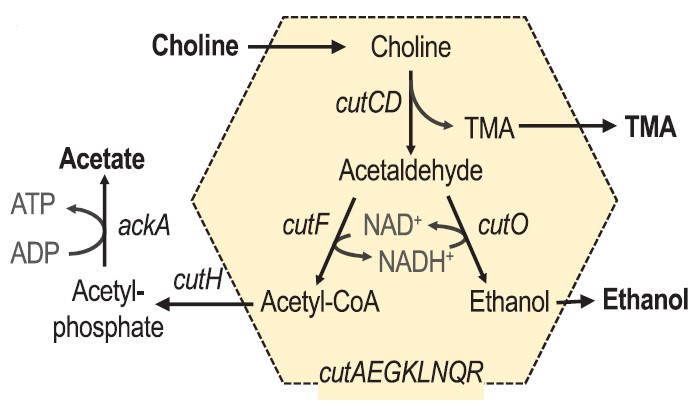
High-fat diet–induced colonocyte dysfunction escalates microbiota-derived trimethylamine N-oxide. Science. 2021. DOI: 10.1126/science.aba3683.
原文下载,请长按识别下方二维码

十一、 Gut | 综合代谢组学特征揭示门静脉血清代谢组的改变诱发肝细胞癌HCC

肝细胞癌(HCC)是癌症死亡的第三大原因,5年生存率为50-70%,代谢物在HCC的发病机制中起着重要作用,但以往代谢组学研究多采用外周血来反映HCC患者的代谢变化,而门静脉代谢组特征尚未见报道。本研究采用综合代谢组学分析门静脉血液中代谢物的变化,并与HCC患者和健康肝供者肝脏组织和粪便样本中的代谢物变化进行比较,以发现可能促进HCC进展的代谢改变,为预防HCC发展提供潜在靶点。
(1) 在发现队列中,收集102例受试者(52例HCC患者和50例健康对照组)的血清(门静脉和中心静脉)、肝组织(52例HCC肿瘤和52例癌旁组织、50例正常肝脏)和102例粪便样本; 独立验证队列中包含100例受试者(50例HCC患者和50例健康对照),共660例样本采用非靶向代谢组学进行分析,且候选代谢物的功能在肝细胞中进一步验证;
(2) 代谢组学结果显示HCC患者和对照组的血清、肝组织和粪便样本中有明显的代谢物簇改变,HCC门静脉血清及肿瘤组织中DL-3-苯乳酸、L-色氨酸、甘胆酸、1-甲基烟酰胺致病性代谢物增多,与肝功能受损及预后不良有关,HCC门静脉血清和粪便中亚油酸和苯酚显著抑制肝癌细胞增殖的保护性代谢物减少;
(3) 通过对门静脉和中心静脉血清、肝组织和粪便代谢物的综合代谢组分析揭示了 HCC 患者以前未报道的代谢改变。在门静脉、肠和肝之间的关键体液通讯途径中发现了致病性代谢物的增加和保护性代谢物的耗竭,表明它们在HCC的发展中起着关键作用。
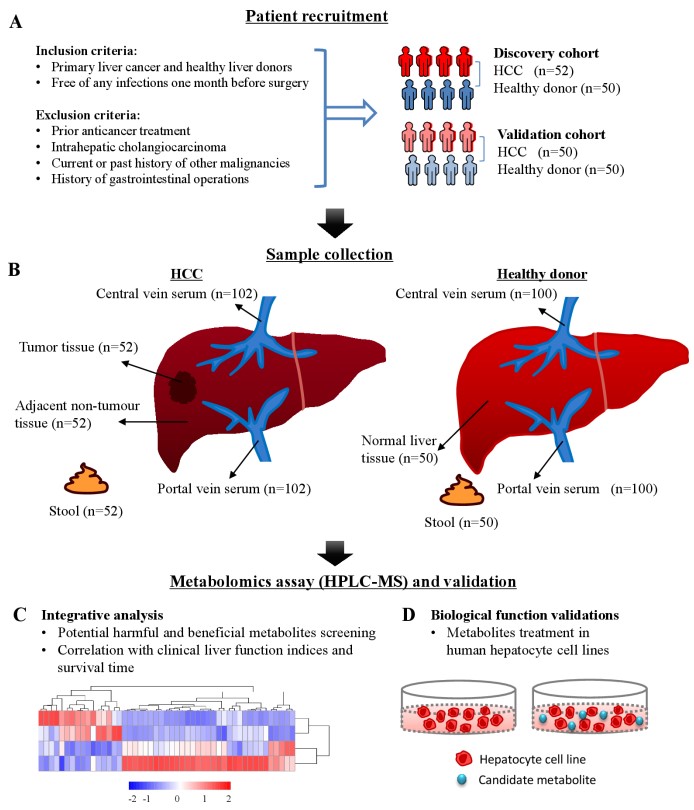
Integrative metabolomic characterisation identifies altered portal vein serum metabolome contributing to human hepatocellular carcinoma. Gut. 2021. doi:10.1136/gutjnl-2021-325189.
原文下载,请长按识别下方二维码

精彩推荐


