概述
噬菌体T7 RNA聚合酶(T7 RNA Polymerase,T7 RNAP)于1970年首次从噬菌体T7感染的大肠杆菌细胞中分离出来,是催化RNA合成的最简单的酶之一。T7噬菌体是一种中等大小的噬菌体,其线状双螺旋DNA由39, 936 bp组成。39, 936 bp T7线性基因组的关键基因可以分为三大类,并且这三大类基因在T7感染周期的不同阶段进行表达:I类基因在感染早期表达,为噬菌体生长建立有利条件;II类是主要参与DNA复制、蛋白编码的基因;III类基因则在噬菌体生长的后期表达,主要编码结构基因。多年来,T7 RNAP已广泛应用于原核生物和真核生物中的高水平基因表达,并在生物学其他领域的应用得到扩展,例如RNA干扰、RNA编辑、合成基因电路、构建Vaccinia / T7混合系统等(如图1)。如在工业生物技术中,基于T7 RNAP的表达系统,研究者开发出谷氨酸棒杆菌MB001和大肠杆菌BL21(DE3)两个底盘菌株。由于T7 RNAP在原核环境中产生,因此T7 RNA聚合在真核环境中表达会遇到以下三种困难:i)mRNA加工,ii)加帽,iii)甲基化,和iv)真核环境中的多腺苷酸化。
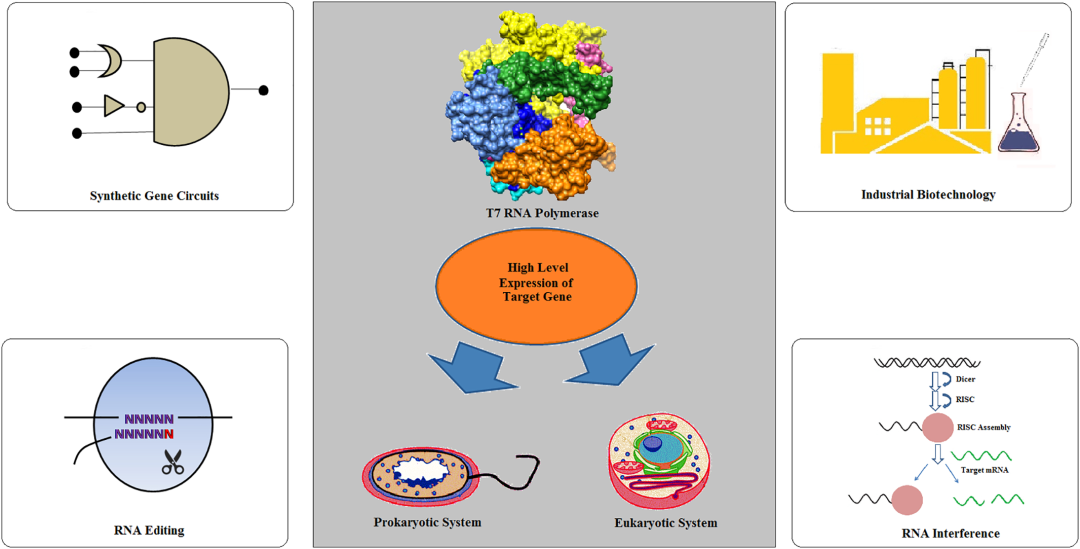
图1: T7RNAP 在生物领域的多方面作用[1]
特征
T7 RNAP 具有许多有趣的特性:
(1) 与多亚基原核和真核RNA聚合酶相比,它是一种单亚基酶[2],
(2) 对T7启动子具有高度特异性;但对无关的DNA甚至T3启动子不起作用[3],
(3) 不需要任何额外的蛋白质因子来完成完整的转录[4],
(4) T7 RNAP表现出有效的伸长率。它的伸长速度比大肠杆菌RNA聚合酶快约五倍,并产生非常长的转录本[5],
(5) 只能通过I 类和 II 类终止信号来执行转录终止,并且它独立于大肠杆菌RNA聚合酶的转录终止因子[6, 7]。
这些特性增加了这种酶的优势,因此被广泛应用于在 T7 启动子的控制下表达异源基因,用于体内和体外实验。
结构与功能
T7 RNA聚合酶由883个氨基酸构成,蛋白质分子量为99 kDa,在20世纪80年代早期,已有研究者确定其一级结构。该多肽在结构上与含有单亚基DNA聚合酶和RNA聚合酶的核苷酸聚合酶家族相似,例如大肠杆菌DNA聚合酶I和逆转录酶。T7 RNAP由N-末端结构域(残基1-325)和聚合酶结构域(残基326-883)组成(见图2a)。T7 RNAP 结构的聚合酶结构域类似于右手,类似于其他核酸聚合酶结构。在催化中心具有 Mg2+ 离子的 T7 RNAP 的三维模型结构如图 3b 所示。聚合酶结构域可以分为表示为拇指(残基326-411),手掌(残基412–449,528–553,785–879)和手指(残基554–739,769–784)子结构域。由两个亚结构域形成的间隙是DNA模板的结合位点。针对启动子和聚合酶复合物的晶体结构的研究指出,N-末端结构域(残基1-325)的两个主要区域在序列特异性启动子结合和打开双链 DNA 中发挥着重要作用。
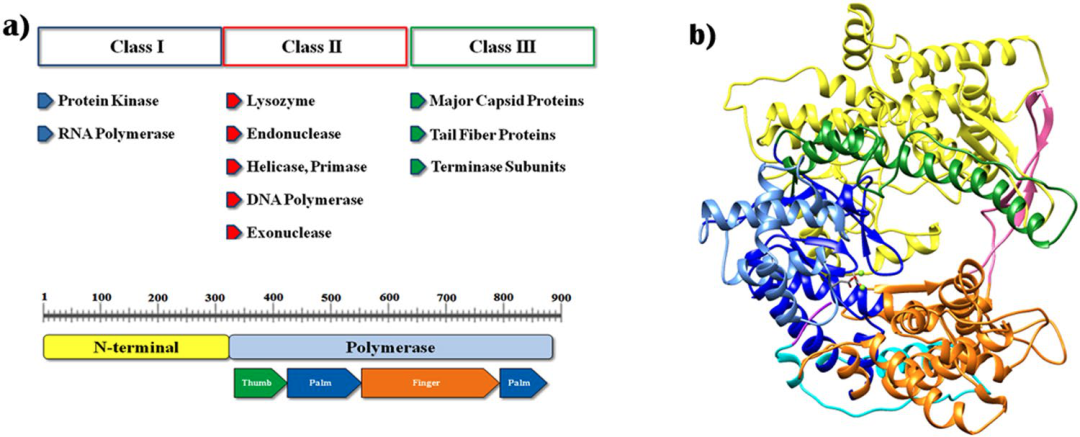
图2:T7 RNA聚合酶的结构[8]
(a) T7 噬菌体基因组的主要基因产物和具有主要亚结构域的 T7RNAP 的结构域结构;(b) T7RNAP模型结构:颜色表示如下,N端域(1-325):黄色;拇指(326-411): 绿色; 手掌(412–449, 528–553, 785–879): 深蓝; 手掌插入模块 (450–527):浅蓝; 手指(554–739, 769–784): 橙色;特异性loop (740–769): 粉红色;extended foot module(838–879): 青色;C-末端结构域(880–883): 紫色。活性位点的两个金属离子显示为绿色球体。
T7 RNAP可催化从5’到3’方向的RNA合成。T7 RNAP对T7噬菌体启动子具有高度的特异性,通过识别特定的T7启动子序列并启动转录过程,利用ATP、CTP、GTP与UTP这四种天然核苷酸作为底物,通过与DNA模板碱基配对,按照碱基互补配对原则合成RNA。T7 RNAP需要DNA模板和镁离子(Mg2+)作为辅因子共同参与RNA的合成过程。牛血清蛋白及精胺对T7 RNAP具有促进效果。其与细菌的RNA聚合酶的差异之一,在于T7 RNA聚合酶不受抗生素立泛霉素的抑制。
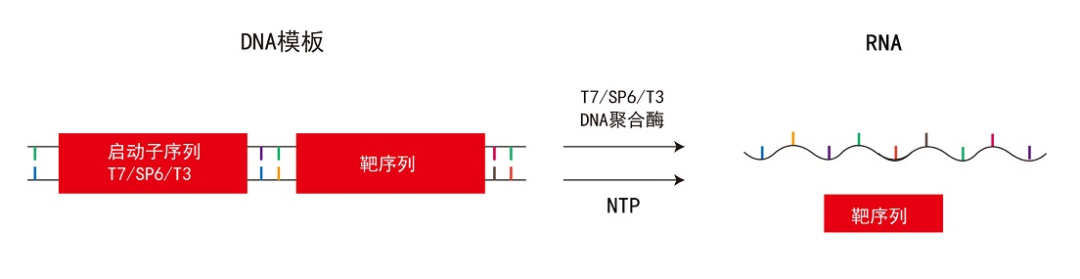
图3:体外转录过程[8]
改造
虽然T7 RNAP广泛应用于RNA的体外合成、体内蛋白表达(细菌高表达系统)等,但除了转录高效、延伸能力强等优点外,其作为体外RNA合成工具也存在一些不可忽略的缺点。T7 RNAP在合成RNA的过程中可能会产生许多的副产物,包括转录起始过程中产生的寡核苷酸、终止信号造成的中断RNA产物、依赖RNA的RNA聚合酶活性造成的3’末端延伸产物等。因而,急需优化改进T7 RNAP,使其不仅能维持高效转录,同时也能够降低RNA产物不均一的问题。现有技术中,中国授权**CN 102177236 B提供了功能改善的RNA聚合酶突变体,通过将构成野生型T7 RNAP的氨基酸序列中的786位的谷氨酰胺、179位的赖氨酸以及685位的缬氨酸中的至少1个位置的氨基酸残基替换为其它氨基酸,提高了这种T7 RNAP突变体的热稳定性和/或比活性。中国**申请CN 107460177 A提供了可利用化学修饰核苷酸的RNA聚合酶突变体,通过将构成野生型T7 RNAP的氨基酸序列中的632位的精氨酸替换为半胱氨酸,大大提高了T7 RNAP转录活力。美国也有一些**对野生型T7 RNAP进行了改造,例如美国**US6524828B1通过使T7 RNA聚合酶核苷酸序列的第1897位发生T→C定点突变,导致所述T7 RNAP的氨基酸序列的第633位丝氨酸变为脯氨酸,这种方法增加了RNA聚合酶突变体的稳定性。
类型
T7 RNA聚合酶可分为:常规型和耐热型。常规型T7 RNA聚合酶可在37℃对模板进行高效体外转录,而耐热型T7 RNA聚合酶可在更高的温度下进行体外转录。基于此耐热的体外转录反应特性具有以下优势:
(1)提升了GC含量较高RNA的转录效率;
(2)提升了长片段RNA的合成能力;
(3)在使用帽类似物时,提高了共转录的加帽效率;
(4)减少了dsRNA 副产物的形成,降低了合成RNA的免疫原性。
近岸蛋白转录试剂盒(货号:E131)高度特异识别T7启动子序列,能够转录不同大小的片段(如图4所示),体外转录得到的RNA完整性好(如图5所示)。并且可以在高于37℃条件下进行高效的体外转录,有效降低dsRNA含量。
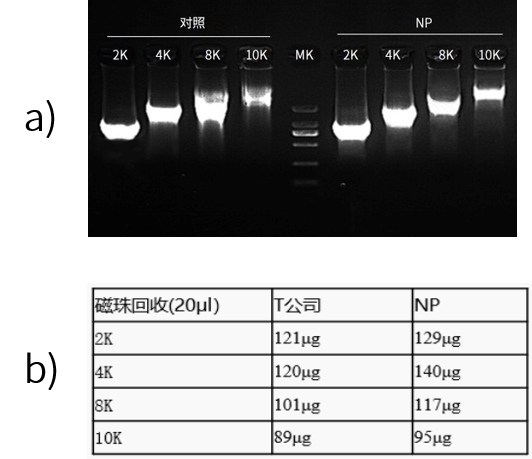
图4:Qubit数据显示,Novoprotein试剂盒20μl转录体系产物磁珠纯化后产量在100-150 μg。
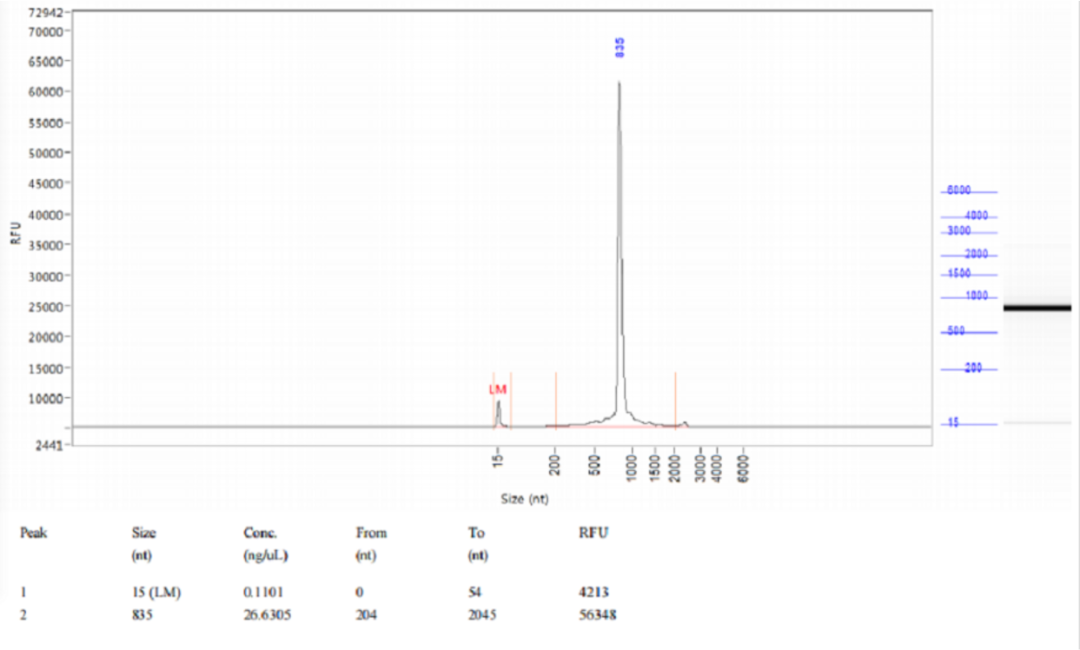
图5:Qsep1结果显示,体外转录得到的RNA完整性良好。
针对耐热转录体系,近岸蛋白做了不同温度下转录产量及dsRNA含量的测试。
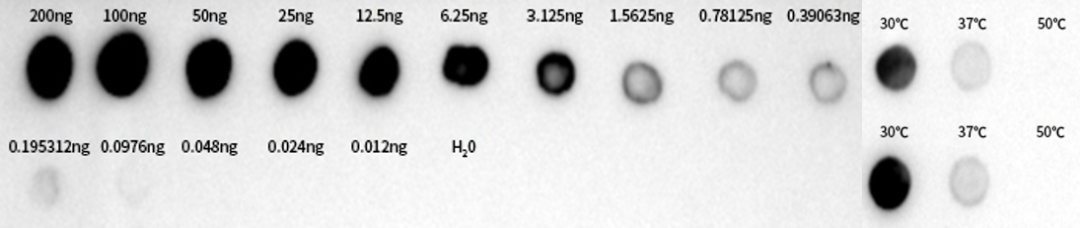
图6:采用未修饰dsRNA标准品进行DotBlot实验及不同转录温度下dsRNA含量测定
如图6显示,转录温度越低,dsRNA含量越高,当转录温度达到50℃时,几乎检测不到dsRNA。
在考虑dsRNA含量的同时,RNA产量同样也是关键指标,近岸蛋白对在不同转录温度下的RNA产量做了测定。

如图7所示,针对4kb长度片段,转录温度提高后,产量没有很大的影响, 20ul转录体系依然可以做到130ug以上的产量。
mRNA药物研究发展得如火如荼,探索不同的技术路径和反应体系以解决当前面临的转录纯度、加帽率等问题成为研究者们最为关注的重点之一,随着整个行业的不断发展,相信成熟的mRNA技术就在不远的前方。
相关产品:
|
目录号 |
产品名称 |
参考文献
[1] Borkotoky Subhomoi,Murali Ayaluru,The highly efficient T7 RNA polymerase: A wonder macromolecule in biological realm.[J] .Int J Biol Macromol, 2018, 118: 49-56.
[2] V.L. Tunitskaya, S.N. Kochetkov, Structural-functional analysis of bacteriophage T7 RNA polymerase, Biochemistry. Biokhimiia 67 (2002) 1124-35.
[3] J.F. Klement, M.B. Moorefield, E. Jorgensen, J.E. Brown, S. Risman, W.T. McAllister, Discrimination between bacteriophage T3 and T7 promoters by the T3 and T7 RNA polymerases depends primarily upon a three base-pair region located 10 to 12 base-pairs upstream from the start site, Journal of molecular biology 215 (1990) 21-9.
[4] G.M. Cheetham, T.A. Steitz, Insights into transcription: structure and function of single-subunit DNA-dependent RNA polymerases, Current opinion in structural biology 10 (2000) 117-23.
[5] P.A. Pavco, D.A. Steege, Characterization of elongating T7 and SP6 RNA polymerases and their response to a roadblock generated by a site-specific DNA binding protein, Nucleic acids research 19 (1991) 4639-46.
[6] D.L. Lyakhov, B. He, X. Zhang, F.W. Studier, J.J. Dunn, W.T. McAllister, Pausing and termination by bacteriophage T7 RNA polymerase, Journal of molecular biology 280 (1998) 201- 213.
[7] L.E. Macdonald, R.K. Durbin, J.J. Dunn, W.T. McAllister, Characterization of two types of termination signal for bacteriophage T7 RNA polymerase, Journal of molecular biology 238 (1994) 145-158.
[8] Borkotoky Subhomoi,Kumar Meena Chetan,Bhalerao Gopalkrishna M et al. An in-silico glimpse into the pH dependent structural changes of T7 RNA polymerase: a protein with simplicity.[J] .Sci Rep, 2017, 7: 6290.
苏州近岸蛋白质科技股份有限公司,是一家专注于重组蛋白应用解决方案的高新技术企业,主营业务为靶点及细胞因子类蛋白、重组抗体、酶及试剂的研发、生产和销售,并提供相关技术服务。公司定位为医疗健康与生命科学领域原料与技术解决方案的上游供应商,致力于为下游客户提供及时、稳定、优质的产品及服务,助力全球生物医药企业和研究机构的技术与产品创新升级。
详询www.novoprotein.com.cn或致电400-600-0940。
