来势汹汹的新冠疫情推动了mRNA技术的快速成熟,伴随着mRNA疫苗的上市,RNA治疗方案被业界广泛接受,开发速度明显加快:
-
2021年7月6日,Arrowhead Pharmaceuticals公司宣布,其在研RNA干扰(RNAi)疗法ARO-HIF2在治疗晚期透明细胞肾细胞癌(ccRCC)患者的1b期临床试验中获得积极结果。中期分析结果表明,ARO-HIF2缩小了部分患者的肿瘤体积,降低了HIF2α蛋白水平,并表现出一些早期疗效 [注1]。
-
2021年7月7日,Arbutus Biopharma和Vaccitech联合宣布,两家公司已经达成一项临床试验合作协议,将对RNAi药物AB-729+治疗性乙肝疫苗VTP-300构成的免疫治疗组合进行评估,用于治疗已经接受标准核苷(酸)类逆转录酶抑制剂(NrtI)治疗的慢性乙型肝炎病毒(HBV)感染者 [注2]。

注:
1. RNAi药物AB-729:一种利用新型共价偶联N-乙酰半乳糖胺(GalNAc)递送技术靶向肝细胞的皮下注射RNAi疗法
2. 治疗性乙肝疫苗VTP-300:与疫苗作用机制非常类似,利用黑猩猩腺病毒载体(ChAdOx1)和改良牛痘安卡拉病毒载体(MVA)表达乙肝病毒抗原,进而激发抗HBV的免疫应答
RNA基因疗法潜力无穷
◊ 蛋白质替代以恢复单一蛋白质的功能治疗罕见的单基因疾病
◊ 细胞重编程,其中mRNA可用于通过表达转录或生长因子来调节细胞行为
一般而言,设计用于表达治疗性蛋白质的mRNA需具有低免疫原性、较长的稳定性和有效的翻译。mRNA的细胞内递送能够在宿主细胞和组织内表达几乎任何所需的蛋白质,并且它允许保存宿主细胞固有的编码蛋白质的翻译后修饰。
这种方法还可以解决基于蛋白质在递送方面遇到的挑战,尤其是那些旨在恢复细胞内和跨膜蛋白的药物。
RNA药物开发难点
此外核酸药物想要进入体内,还需要面对以下三个难关:
-
RNA的分子量和负电荷使其不能自由通过生物膜
-
RNA容易被血浆和组织中RNase酶降解,被肝脏和肾脏快速清除和被免疫系统识别
-
进入细胞后“卡”在内吞小体中无法发挥功能
以上几点让RNA药物发展面临的技术障碍一直没有变,那就是药物递送。目前,解决递呈问题主要有两个方法:
-
如上提及的改造核酸分子,让其稳定并躲避免疫系统的识别
-
利用药物递呈系统,如脂质纳米颗粒(LNP)和GalNAc(N-乙酰化的半乳糖胺)偶联技术[1,2]
药物递呈系统解决方案:LNP
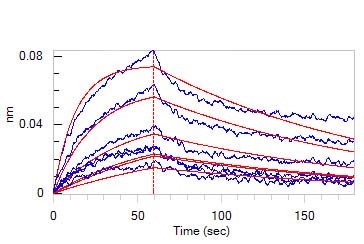
最新研究发现LNP在注入血流后,LNP表面的PEG脂质可以被置换为血清蛋白(如ApoE),并通过受体(如LDL R)介导进入细胞。但进一步研究表明,大多数LNP被困在可降解的内吞隔室中或从细胞中流出,只有一小部分(<2%)到达细胞质发挥作用;尽管研究人员通过优化LNP组分(如添加C-24烷基植物甾醇)可以提升基因转染率,但LNP介导的RNA内体逃逸过程依然有待确认[3]。
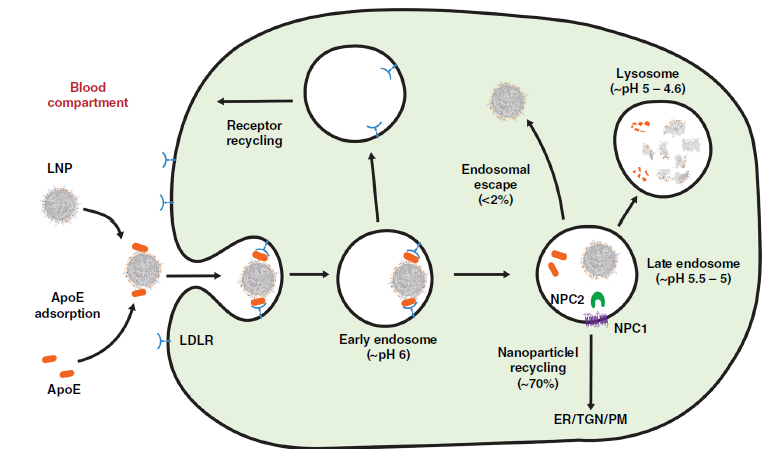
LNP 上的 PEG 脂质可以与 ApoE 结合启动细胞受体 LDL R 介导的细胞内吞
药物递呈系统解决方案:GalNAc 偶联技术
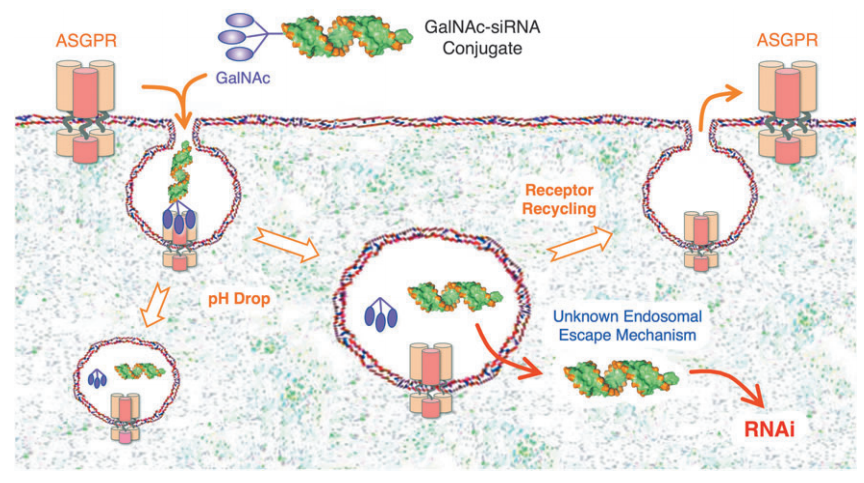
GalNAc-siRNA 偶联物-肝细胞递呈途径
此外,除肝细胞递呈途径,RNA药物还包括肺、中枢神经系统、心血管、肾、胰、肿瘤递呈等多个递呈途径。以前文提及的Arrowhead Pharmaceuticals 公司的RNA干扰(RNAi)疗法为例,该治疗方案是通过ARO-HIF2上连接了一种能够识别在多种癌症类型中高度表达的整合素受体(αVβ3)的化合物,从而让它能够有特异性地靶向肿瘤中编码HIF2α蛋白的mRNA,将脱靶效应最小化。
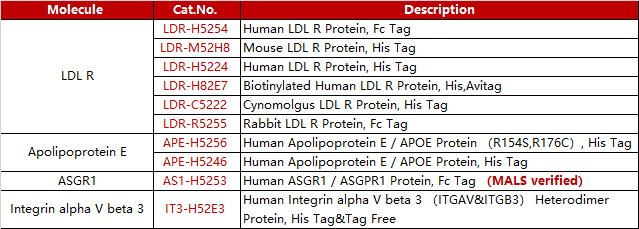
LDL R蛋白覆盖人、猴,鼠,兔等种属,多种标签可共选择;与APOE蛋白的结合活性经BLI验证,亲和力可达nM级别,可用于RNA递呈途径优化,助力RNA创新疗法的加速开发。
> LDL R蛋白与APOE蛋白的结和活性经BLI验证
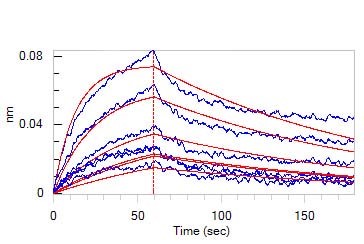
Human LDL R, Fc Tag (Cat. No. LDR-H5254)可结合·Human Apolipoprotein E, His Tag (Cat. No. APE-H5246),亲和常数为 51.2 nM
参考文献
1. Kowalski PS, Rudra A, Miao L, Anderson DG. Delivering the Messenger: Advances in Technologies for TherapeuticmRNADelivery. Mol Ther. 2019;27(4):710-28.
2. Springer AD, Dowdy SF. GalNAc-siRNA Conjugates: Leading the Way for Delivery of RNAi Therapeutics. Nucleic Acid Ther. 2018;28(3):109-18.
3. Patel S, Ashwanikumar N, Robinson E, Xia Y, Mihai C, Griffith JP, 3rd, et al. Naturally-occurring cholesterol analogues in lipid nanoparticles induce polymorphic shape and enhance intracellular delivery of mRNA. Nat Commun. 2020;11(1):983.

您可通过以下方式联系到ACROBiosystems:
邮件:inquiry@acrobiosystems.com
电话:15117918562
(备注:姓名+公司)