
自去年以来,全球制药界最艰巨的任务一直集中在制定治疗COVID-19的战略上。迄今为止,已经开发了几种疫苗,并已证明其在降低COVID-19发病率方面的功效。然而,治疗COVID-19的药物的开发远远落后,目前所有的治疗方案都有其局限性。SARS-CoV-2引起的炎症反应涉及多样化的上游刺激,多种信号通路和众多下游效应器。因此,靶向任何特定的细胞因子甚至信号通路可能不足以缓解严重COVID-19(即细胞因子风暴)中免疫系统的全身过度反应。开发针对炎症信号级联中心节点的调节免疫反应方法是紧迫和关键的。
2022年2月2日,来自北京大学肖瑞平团队,中国医学科学院秦川团队和西湖大学郭天南团队合作在 Signal Transduction and Targeted Therapy(IF 18.187)上发表题为“sRAGE alleviates SARS-CoV-2-induced pneumonia in hamster”的研究文章,该研究明确了可溶性晚期糖基化终产物受体sRAGE对于SARS-CoV-2诱发仓鼠肺炎的缓解作用,并借助蛋白组学深入解析了sRAGE抑制肺炎症状、缓解器官损伤的分子机制,为sRAGE治疗COVID-19的临床使用提供了强有力的实验证据和理论支持。
研究材料
仓鼠,肺组织
技术路线
· 步骤1:sRAGE治疗SARS-CoV-2肺炎的效果分析;
· 步骤2:蛋白组学揭示sRAGE治疗响应的蛋白质组变化;
· 步骤3:功能分析揭示sRAGE治疗COVID-19中介导的信号通路途径。
研究结果
1. sRAGE干预有效缓解SARS-CoV-2诱发的肺炎
晚期糖基化终产物受体(RAGE)是一种多配体促炎模式识别受体,与感染性和无菌性炎症有关。可溶性RAGE(sRAGE)是一种剪接变体或翻译后切割的RAGE的短形式,缺乏跨膜和细胞内C端结构域,充当诱饵受体可减弱由全长RAGE引发的炎症反应。
本研究首先通过SARS-CoV-2接种对仓鼠造成严重肺炎,之后用sRAGE进行干预处理。结果显示sRAGE处理组肺泡间隔弥漫增厚,多灶性渗出以及肺血管周围和支气管周围间隙中炎症细胞的积累显著降低;严重间质性肺炎仓鼠发病率显著降低。免疫组织化学染色表明发现sRAGE治疗抑制SARS-CoV-2诱导的CD3阳性T细胞募集,粘液病毒抗性蛋白1(Mx1)在肺中的表达也大大降低。qRT-PCR表明sRAGE治疗显著抑制巨噬细胞标志物CD68,炎症性疾病标志物(包括IFIT3和Mx1),以及炎症细胞因子(包括IL-1β,IL-6,TNF-α,IL-18和IL-10)的表达。上述结果证实,sRAGE可有效抑制SARS-CoV-2引发的肺炎。
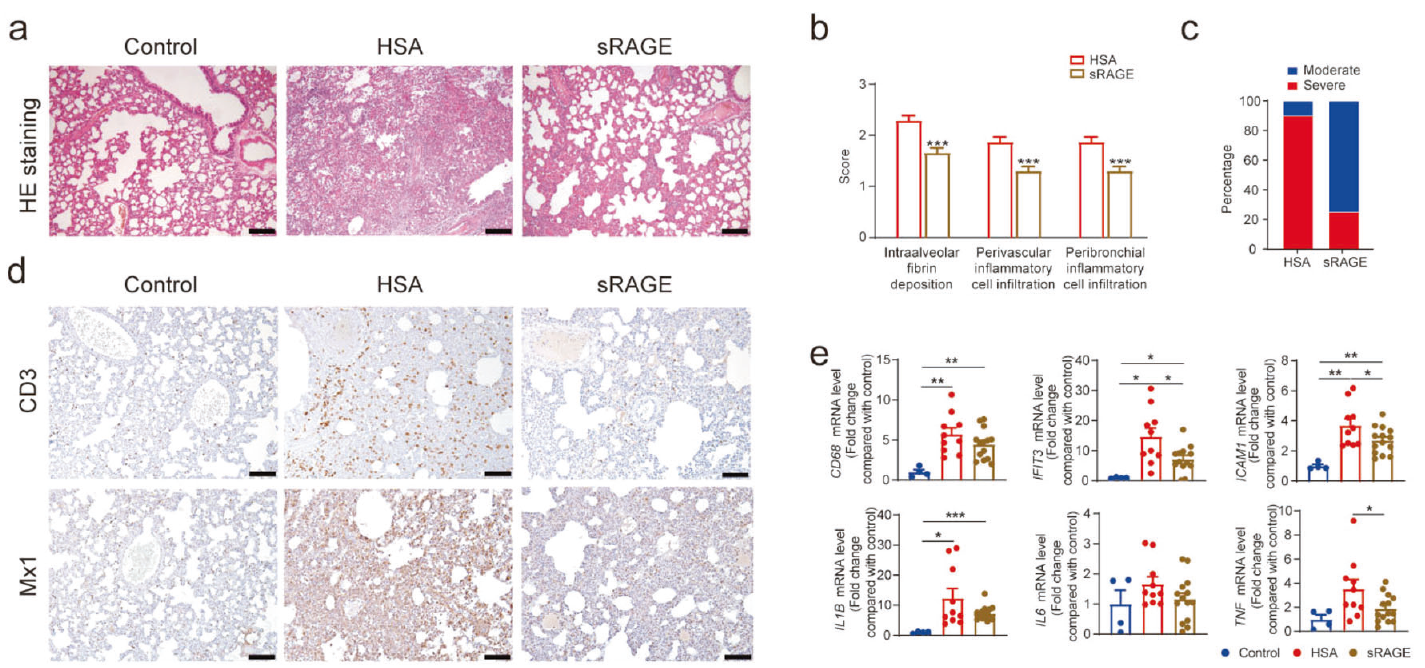
图1 sRAGE治疗缓解SARS-CoV-2引发的肺炎
2. sRAGE干预治疗前后肺组织蛋白质组学分析
研究人员对SARS-CoV-2感染组,sRAGE治疗干预组及对照组仓鼠肺组织进行TMT标记蛋白质组学分析。结果发现sRAGE治疗抑制了SARS-CoV-2感染上调546个蛋白中的408个的表达(74.7%)。通过Reactome和KEGG分析发现在SARS-CoV-2感染时,大多数参与炎症和DNA复制的上调蛋白在sRAGE处理后下调。
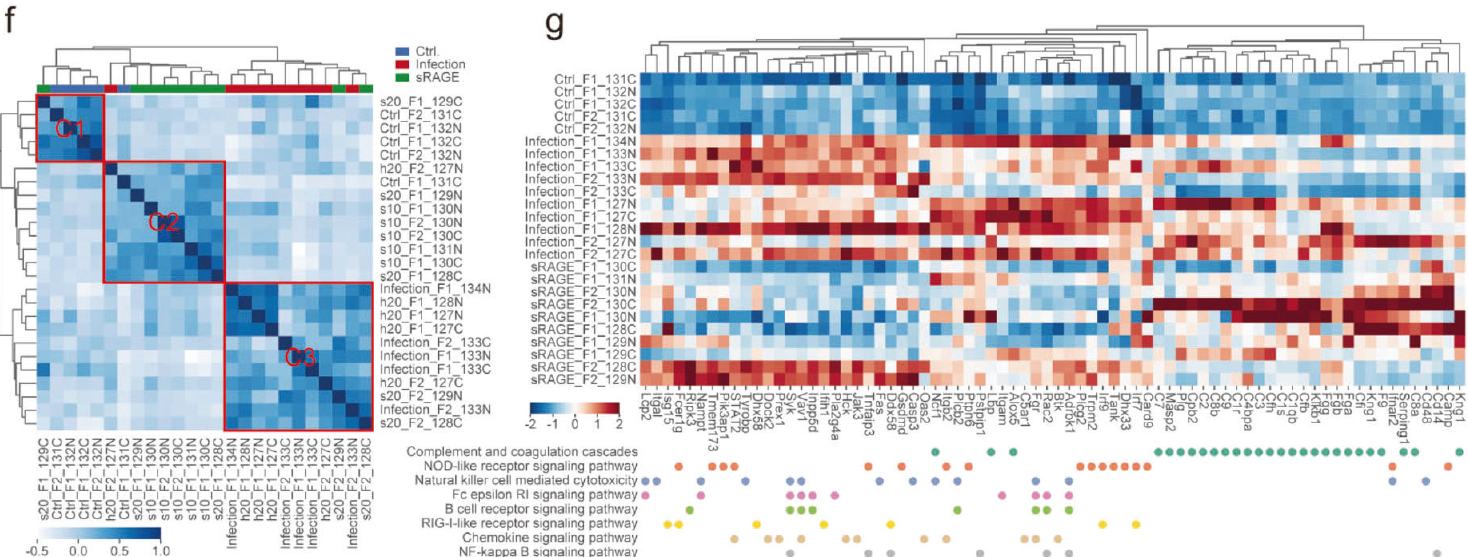
图2 sRAGE干预治疗后的蛋白组学分析
3. sRAGE治疗抑制SARS-CoV-2感染引起的多种炎症信号通路和细胞周期/死亡相关途径
SARS-CoV-2的感染在肺部引发了深刻的炎症反应,正如多种炎症相关蛋白的上调所证明的那样,而这些变化中的大多数通过sRAGE治疗得到改善。对蛋白质组学数据进行深入分析发现,感染诱导的NF-κB、p38、JAK/STAT、Toll-like受体等信号传导通路的改变被sRAGE抑制。此外,与炎症信号传导相关的其他升高蛋白质,包括Cdk7,Ddx58,Dock2和Ifih,也通过sRAGE治疗恢复。综上所述,用sRAGE治疗抑制了病毒引发的多条炎症信号通路。此外,SARS-CoV-2感染诱导的细胞周期/死亡相关途径的激活也通过sRAGE治疗得到缓解。这表明sRAGE治疗改善了SARS-CoV-2感染引起的全身组织损伤。
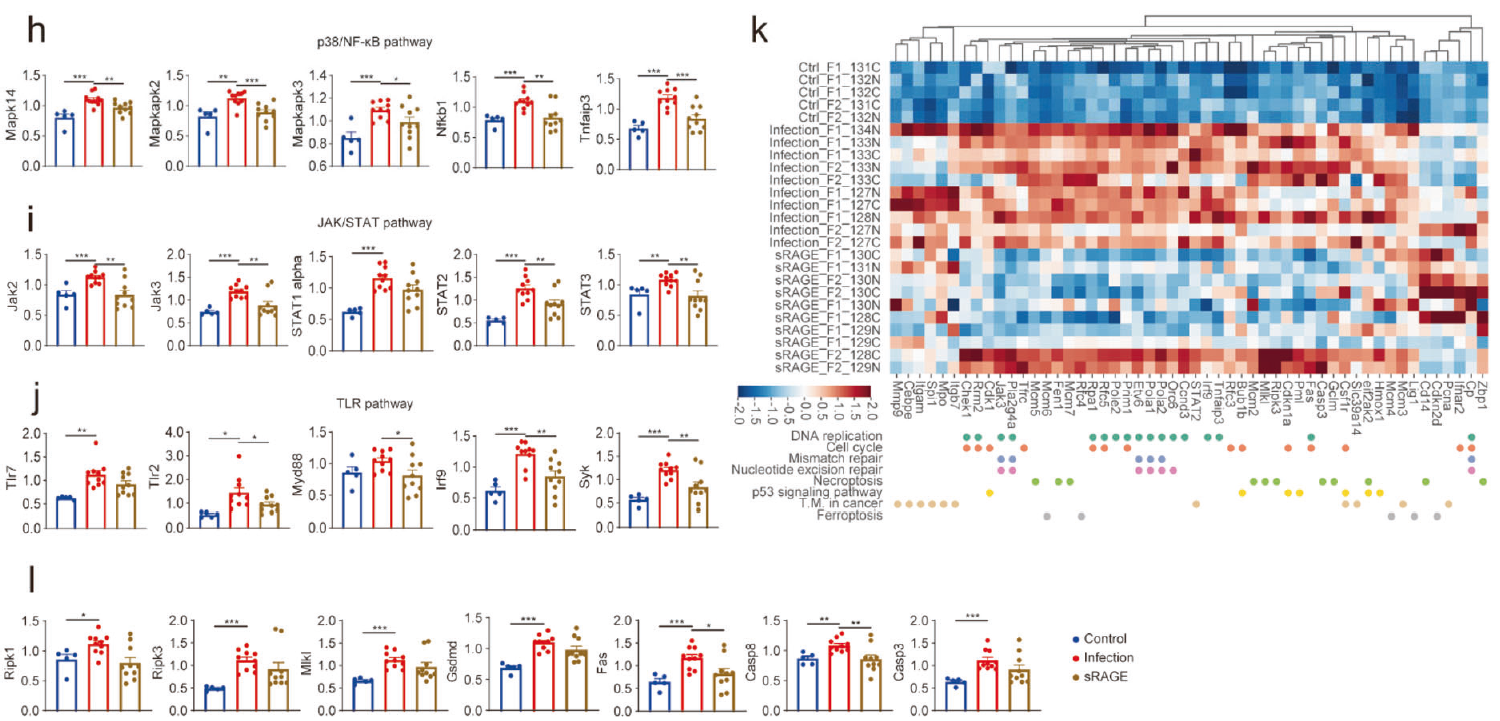
图3 sRAGE可抑制病毒感染引发的炎症和细胞死亡等信号通路
小编小结
本研究通过仓鼠模型发现sRAGE能显著缓解SARS-CoV-2诱导的肺炎和器官损伤,之后借助蛋白组学技术系统解析了sRAGE干预治疗SARS-CoV-2肺炎的分子机理:抑制病毒诱导的炎症信号通路和细胞死亡相关通路。本研究证明了sRAGE治疗COVID-19的临床应用潜力,为新冠肺炎治疗提供了新的策略。
中科优品推荐
【中科新生命】提供蛋白质组、修饰蛋白质组等多种组学检测服务,作为前中科院上海生科院蛋白质研究分析中心,具有超17年项目经验积累,提供最完整、最可靠的组学技术服务,创新引领前沿技术发展。欢迎感兴趣的老师前来咨询。

