
已知蛋白质组的动态可塑性是植物快速适应环境变化的重要机制之一,植物中广泛存在的蛋白-泛素酶体调控了蛋白质的降解,而翻译后修饰则是影响蛋白质稳定性的关键决定因素。最普遍的修饰之一是N末端的乙酰化修饰(NTA),该修饰由N乙酰转移酶A(NatA)催化完成,但翻译后修饰如何调控蛋白的稳定性仍有许多未知。
2022年2月10日,Nature Communications (IF 14.919)发表了一篇题为“Cotranslational N-degron masking by acetylation promotes proteome stability in plants”的文章,该文章采用泛素化蛋白组学和蛋白组学的方法发现依赖于NatA的NTA损伤会导致拟南芥蛋白质组的整体不稳定,并发现了一个新的degron,该degron标记了大多数非乙酰化的胞质蛋白并可通过泛素系统降解。

研究材料
拟南芥叶片
技术路线
· 步骤1:NatA的缺失增强了蛋白的降解;
· 步骤2:在NatA缺失的植物中,发生降解的蛋白质主要是NatA底物;
· 步骤3:在NatA缺失的植物中,胞质NatA底物是不稳定的;
· 步骤4:在NatA缺失的植物中,增强的蛋白质降解被翻译的增加所抵消;
· 步骤5:植物中NatA底物的nonAc-X2/N-degron的鉴定。
研究结果
1. NatA的缺失增强了蛋白的降解
NatA由具有催化活性的亚基NAA10和核糖体锚定的亚基NAA15组成,通过对亚基的敲除,证明NatA的缺失导致了蛋白降解速度增加4倍(图1a)且蛋白酶体活性增加(图1b)、泛素化蛋白增多(图1c)。结果说明NatA的缺失是通过提高内源性泛素化率和增加蛋白酶体的容量导致蛋白质降解速度增快的。
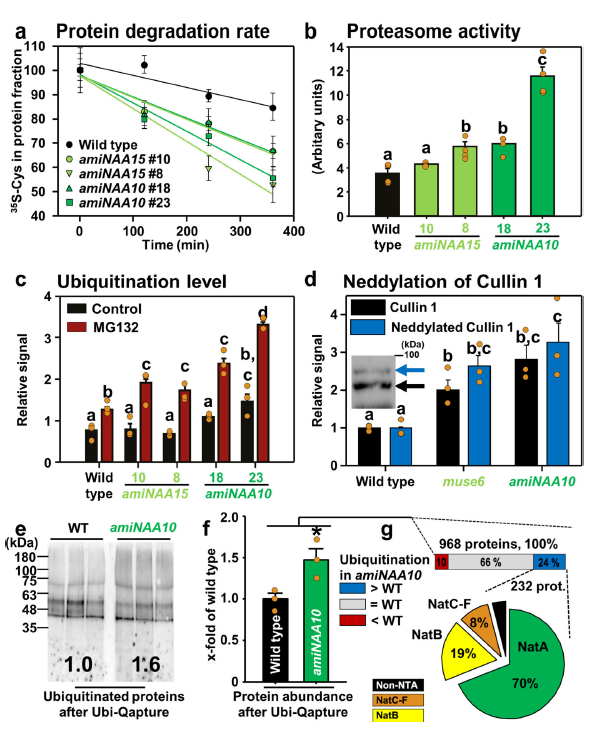
图1 NatA的缺失会通过泛素-蛋白酶体系统影响蛋白的降解
2. 在NatA缺失的植物中,发生降解的蛋白质主要是NatA底物
对泛素化蛋白进行富集并进行蛋白组学分析,结果表明232个蛋白属于显著差异泛素化蛋白,且其中的162个蛋白属于NatA的底物(图1g)。GO分析发现在NatA缺失的植物中,泛素化蛋白主要是胞质蛋白(232个蛋白中有141个),它们参与了不同的胁迫响应和蛋白质折叠(表1)。
表1 泛素化蛋白组学GO分析结果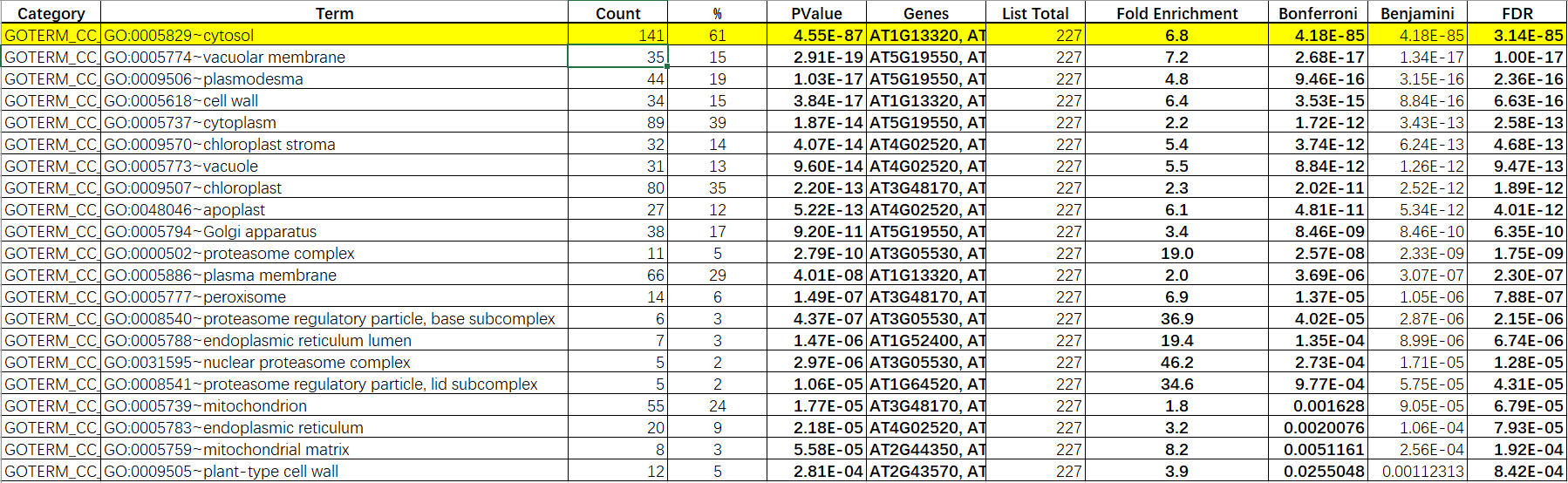
3. 在NatA缺失的植物中,胞质NatA底物是不稳定的
尽管UPS诱导了NatA底物的降解,但NatA损失的植物叶片中的总蛋白含量不受影响(图2a)。对稳态蛋白质的蛋白组学分析,发现在鉴定到的1238个蛋白中仅92个蛋白在NatA缺失的植物中发生了显著变化,然而83%的低稳态蛋白均为NatA的底物(图2b)。随后作者选取显著下调的ARKGR1和非显著上调的ASROAS-TL A(两者均为NatA的底物)进行后续验证,环己酰亚胺追踪(蛋白稳定性实验)结果显示虽ARKGR1和ASROAS-TL A在NatA损失的植物中均显著降解(图2c),但加入蛋白酶体抑制剂MG132后,ASROAS-TL A随即在NatA损失的植物中显著的快速累积(图2e),意味着不稳定的ASROAS-TL A未受影响的稳态水平是由于其受翻译增强的结果。而ARKGR1不受增强的翻译水平的影响(图2e)。非NatA的底物MPPSAT5和MRETUBB4的稳定性不受影响(图2d和2e)。
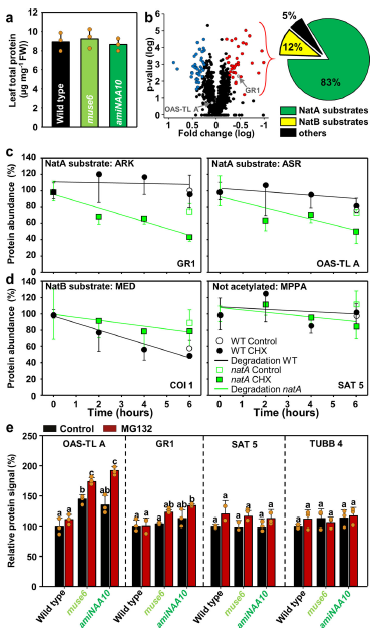
图2 NatA的缺失不影响整体的蛋白水平,但选择性显著影响其底物
4. 在NatA缺失的植物中,增强的蛋白质降解被翻译的增加所抵消
实验结果发现,在NatA缺失的植物中,其翻译水平较正常组织提高了4倍(图3a),这是由于其对多种蛋白质的选择性翻译增强导致的(图3b)。而这种翻译增强是通过影响TOR蛋白(核糖体数量的主要调控蛋白)的活性引起的(图3c和3d)。为寻找新翻译的蛋白,作者进行了蛋白组学分析(共鉴定到913个蛋白),结果发现新翻译的蛋白大多为NatA的底物(图3g)。泛素化蛋白组学和新翻译蛋白的蛋白组学的结果进一步表明了由于N乙酰化水平受损所导致的NatA底物的选择性失稳被其翻译增强所抵消从而维持蛋白的稳态水平。
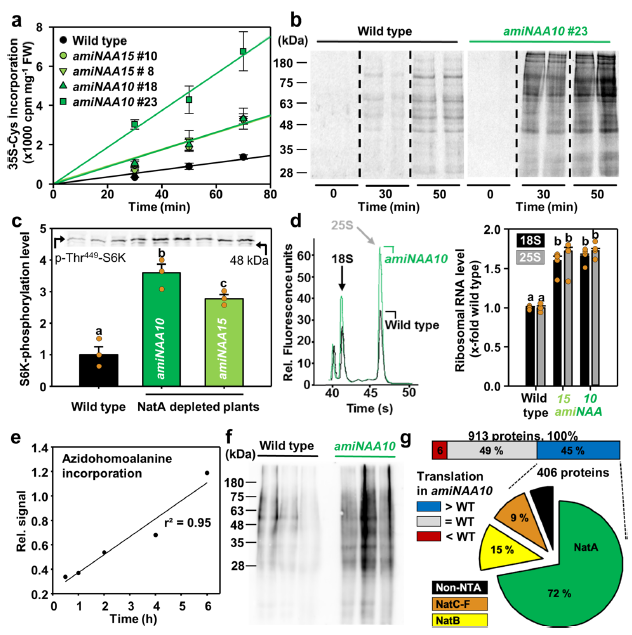
图3 NatA缺失的植株中表现出较高的NatA底物翻译率
5. 植物中NatA底物的nonAc-X2/N-degron的鉴定
为验证NatA底物NTA的降低会增强蛋白的周转,作者对NatA底物(ASROAS-TL A)和非NatA底物的半衰期进行了研究。结果发现NatA缺失植物中OAS-TL A的半衰期比正常植物中的显著变短(图4a),而非NatA底物的半衰期未发生变化(图4b和4c)。为验证位置2的Ala是引起蛋白不稳定的原因,作者构建了APSOASTL A,实验结果发现APSOASTL A在正常植物中的半衰期与NatA缺失植物中ASROAS-TL A的半衰期一致,证明了Ala2中NTA的缺失导致了植物中OAS-TL A的不稳定。由此作者发现了不稳定信号并将其命名为nonAc-X2/N-degron。10个NatA底物蛋白进行了验证(图4d),结果表明NTA的缺失是蛋白质相对半衰期降低的原因。
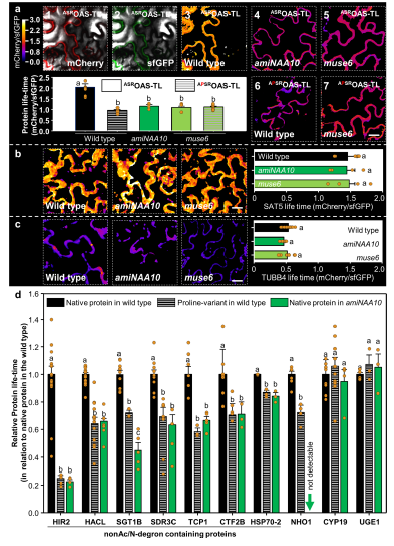
图4 NatA缺失植物中蛋白质半衰期的测定
小编小结
中科优品推荐
翻译后修饰是蛋白质复杂性的重要原因,许多调控网络不仅受到蛋白表达水平的调控,而且也来自于翻译后修饰,在某些调控过程中,翻译后修饰甚至比蛋白更重要。
【中科新生命】提供多元化的、完善的翻译后修饰组学服务,技术成熟、数据可靠、分析齐全。同时可联合蛋白质组、代谢组等多个组学进行机制+表型完整的一体化研究,欢迎感兴趣的老师前来咨询。

