尽管嵌合抗原受体(CAR)为基础的治疗方法取得了相当大的进展,实体瘤的治疗并未从这尖端的技术受益。与B细胞恶性肿瘤相比,实体瘤更带来了一系列不同的挑战,包括肿瘤抗原的异质性表达。研究人员虽然已经探索了针对与实体瘤相关的不同抗原,并取得了一些成功,但抗原逃逸仍然会降低这些疗法的疗效。
除了抗原特异性之外,另一个可能影响疗效的是CAR和抗原的结合强度。CAR分子外部,包括CAR T细胞和CAR自然杀伤(NK)细胞,能识别癌细胞上的抗原,形成分子和抗原复合体,称为免疫突触。免疫突触能激发CAR免疫细胞中的抗原依赖性信号通路,并杀死癌细胞。然而,传统CAR分子与抗原形成的突触是无序和低效的。相较于T细胞超分子激活簇(SMAC)免疫突触,传统CAR分子需要更高的抗原来启动下游信号传导并激活效应细胞。
庆幸的是,研究人员发现CAR分子是可以通过改造来增强结合的强度。“锚定域”是蛋白质中有助于稳定突触的部分。这有可能被利用来改善CARs和其抗原之间的联系,从而产生更强的下游信号并提高疗效。通过使用PhenomeX家族的单细胞功能蛋白质组学平台,研究人员能够确定细胞功能的特征,并显示新的修饰如何影响功能细胞的分泌。
利用PhenomeX单细胞蛋白质组学鉴定新的CAR修饰的特征

今年二月,美国圣裘德儿童研究医院的Peter J. Chockley和他的团队发表在《Nature Biotechnology》的文献研究了在CAR NK细胞中用于识别肿瘤抗原的关键蛋白上添加一个分子锚,如何加强CAR NK的细胞疗效1。他们重点关注CRTAM的PDZ结合模体(PDZbms)。这不单因为大约有400个蛋白质含有PDZ结构域,而且PDZbms有助于突触的形成。至于CRTAM蛋白以前被证明在NK细胞的肿瘤免疫监视中起作用。Chockley和团队将研究重点放在NK细胞上,因为:
- 它们具有先天的杀伤肿瘤细胞的能力并含有比T细胞多5到7倍的细胞颗粒
- NK 细胞不会引起移植物抗宿主病
- 除了CAR NK抗原识别轴之外,NK细胞采用了多种靶向模式,因而降低肿瘤细胞躲避攻击的能力
他们改造了四种CAR:典型CAR NK细胞(CAR NK),CAR改造NK细胞(CAR.PDZ NK),及非功能性对照CAR(CARΔ NK),并以两种不同的肿瘤相关抗原–EphA2和B7-H3为目标,并进行了测试,以确定结合是否增强,以及这是否增加了NK细胞的活性。被称为CAR.PDZ的改良NK细胞首先被证明跟对照细胞相比与目标抗原的结合更强。作者认为这建议它更有力地激活了下游的信号通路。

为了了解这对功能的影响,研究人员使用PhenomeX的IsoCode单细胞蛋白分泌组平台对新型CAR-NK细胞进行功能表型。当作者比较多功能性细胞(分泌两种或更多细胞因子的细胞)百分比时,与CAR、CARΔ和未修改的NK细胞相比,发现CAR.PDZ NK细胞的多功能细胞百分比最高。接下来,研究人员评估了单细胞多功能强度指数(PSI),即将多功能性百分比与被测量的每个单独蛋白质的数量相结合。与其他组相比,CAR.PDZ NK细胞的PSI明显更高,其中效应蛋白对PSI的贡献最大。研究人员还细分了各组蛋白质的分泌频率,发现与典型的CAR-NK细胞相比,CAR.PDZ NK细胞中分泌穿孔蛋白和分泌干扰素的细胞有所增加。这些结果与作者之前观察到的信号通路的变化相一致,提供了更多关于结合力增强的CAR-NK细胞功能改善的机制的信息。
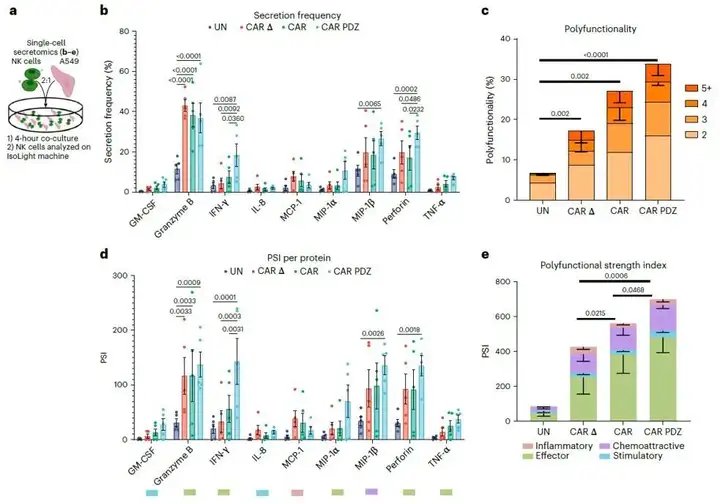
值得一提的是,作者也从IsoSpeak软件自动绘制的t-SNE图看到细胞因子(GM-CSF、IFNγ、IL-8和TNFα)、趋化因子(MCP-1、MIP-1α和MIP-1β)和细胞溶解颗粒的分子(颗粒酶B和穿孔蛋白)的信号强度。他们得以清楚了解到CAR.PDZ细胞与其他NK细胞群相比,是独特的。
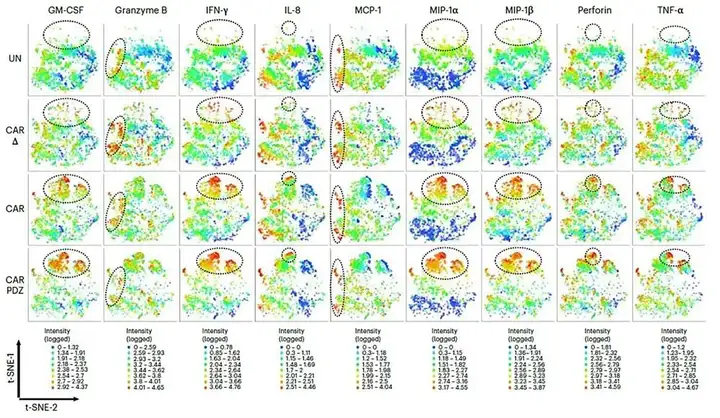
在充分描述了改性NK细胞的特征后,作者还探讨了改进的CAR结合如何改变T细胞的功能。与NK细胞一样,CAR.PDZ T细胞在用单细胞功能表型进行评估时显示出功能的改善。改良后的CAR在体外和体内研究中也提高了细胞毒性活性,改善了动物模型的结果和生存。
使用单细胞功能表型来评估新疗法

通过使用PhenomeX的单细胞多功能分析技术,研究人员可以轻松评估新改造产品如何影响免疫细胞的活性,从而获得对细胞功能的独特见解。多重功能性和PSI都被证明可以预测体内活性和临床结果,使它们成为细胞表征的强大指标。利用PhenomeX的单细胞功能表型,研究人员获得关于免疫细胞功能的可改造的见解,从而指导开发更有效的疗法并改善临床结果。
参考文献:
- Chockley, Peter J et al. “Synapse-tuned CARs enhance immune cell anti-tumor activity.” Nature biotechnology, 10.1038/s41587-022-01650-2. 2 Feb. 2023, doi:10.1038/s41587-022-01650-2
关于PhenomeX
PhenomeX(NASDAQ: CELL)致力于助力科学家充分探索每个细胞的潜能,推动功能细胞生物学迈向新纪元,以促进人类健康发展。我们为科学家提供揭示细胞功能的完整见解,使其全面了解每个细胞的深度功能表征。我们经过验证的独特高通量工具和服务提供了无与伦比的解决方案,加速了多功能细胞研究发展,成为改善疾病预防和治疗的关键。我们屡获殊荣的平台已获得全球各地研究人员的高度认可,包括全球前15家制药公司的研究人员,以及约85%的美国**综合性癌症中心的科研人员。
PhenomeX家族的单细胞功能表征平台(原Berkeley Lights)Beacon®基于其特有的光电定位技术 (OptoElectro Positioning, OEP™) 为广大科学家提供了先进的研究手段,对数以万计单细胞的基因信息、功能等进行深入表征,以筛选出满足用户需求的目的细胞。Beacon®应用场景涵盖抗体发现、细胞株开发、传染病研究、免疫学研究、肿瘤生物学研究、细胞疗法开发、基因编辑、农业科学等多个领域,为从事尖端的科研项目及加速企业生物产品的开发提供了前所未有的机遇。
PhenomeX家族的单细胞蛋白质组学平台(原IsoPlexis)是单细胞多组学不可或缺的重要组成部分,在临床科研领域,针对评估和检测人体单细胞免疫能力、筛选癌症治疗方案、预测评估临床疗效及安全性等方面有着丰富的成功经验,为预测病人长期生存、早期筛选治疗获益患者提供了详实的参考数据,帮助世界各地的科研人员在肿瘤免疫、细胞治疗、肿瘤学、抗感染免疫研究及疫苗开发、自身免疫病、移植免疫等方向取得了众多突破性成果,助力加速临床科研、医学和生命科学行业发展。
IsoPlexis和Berkeley Lights已合并成立新公司PhenomeX
