蛋白质印迹或免疫印迹 (Western blot,简称 WB) 是一种常见的实验室方法,用于检测蛋白质并评估其表达水平。根据其分子量和与特定抗体的免疫反应性来鉴定感兴趣的蛋白质。蛋白质印迹由一系列相互关联的步骤组成 (图 1)[1]。
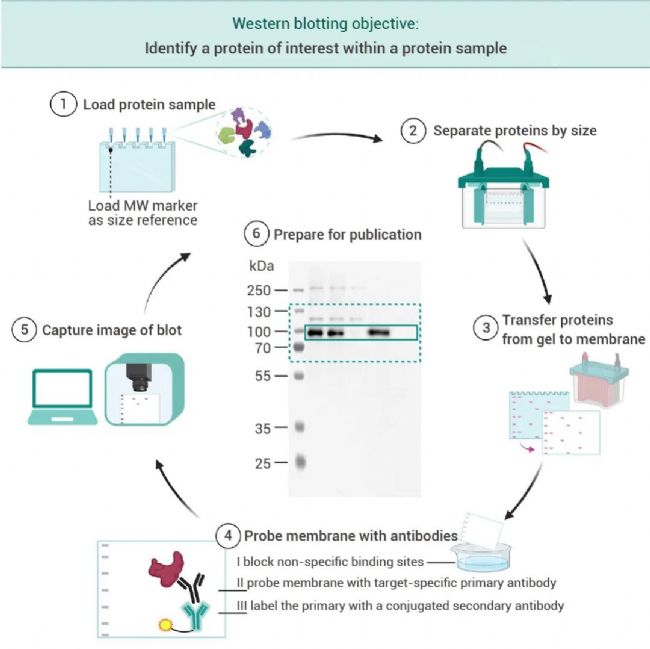
图 1. 蛋白质印迹相互关联的步骤[1]。
(1) 将样品 (通常是蛋白质混合物) 加载到凝胶上。Marker 标记包含各种已知分子量的预标记蛋白质,与蛋白质样品一起加载到凝胶上作为尺寸参考。(2) 凝胶电泳用于根据蛋白质的分子量来分离蛋白质。(3) 将蛋白质转移或“印迹”到膜上。(4) 封闭膜以减少非特异性结合,然后依次用特异性结合目标蛋白的一抗和二抗进行探测。后者结合一抗并携带允许随后检测的酶或荧光团。(5) 分别通过化学发光反应或荧光检测信号。(6) 准备蛋白质印迹图像以供发表。
由于该实验时间长、细节多,从样品制备到显影,每个步骤中都可能存在问题,最后得到的条带往往千奇百怪、不尽人意……在这篇推文中,我们将为您介绍一些常见的 WB 实验问题以及相应的解决方案[2]。小 M 助您避免实验中的各种困扰,快来看看吧!






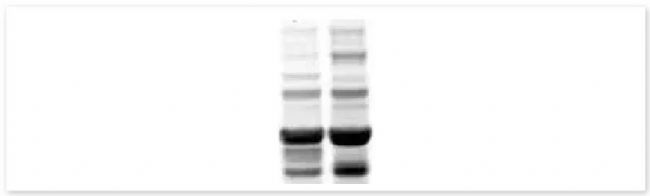

 ▐ 1. 微笑条带:
▐ 1. 微笑条带:

可能性原因:迁移过快、电泳缓冲液温度偏高、蛋白质超载或孔内运行缓冲液不足。
建议:应降低迁移速度、预冷缓冲液、减少蛋白上样量、缓冲液完全覆盖孔,确保内室缓冲液不会泄露到外室[4][6]。
▐ 2. 皱眉条带:
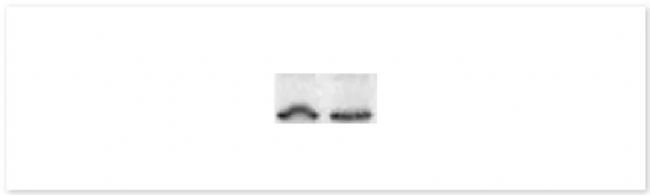
可能性原因:装置不合适,可能是凝胶和玻璃挡板底部有气泡,或者两边聚合不完全。
建议:可通过调整装置来避免该问题。
▐ 3. 条带拖尾:

可能性原因:样品溶解不好;存在一定程度地蛋白降解;电泳液反复多次使用。
建议:样品充分溶解混匀后上样;尽量使用新鲜样本;使用新鲜配制的电泳缓冲液。
▐ 4. 哑铃状不均匀条带:

可能性原因:配置胶有问题,胶凝固后不均一;样品可能含有过多杂质。
建议:重新配置胶,确保胶质量无问题来避免该现象出现;在样品使用前离心。
▐ 5. 条带粘连:

可能性原因:可能是上样量太多,或者是制胶问题,分离胶和浓缩胶之间有间隙,样品窜孔。
建议:可通过减少上样量和提高配胶质量来避免。
▐ 6. 条带空泡:

可能性原因:转膜时膜上有气泡
建议:确保在组装“三明治”时,移除凝胶和印迹膜间的所有气泡。
▐ 7. 背景有不均匀的黑色斑点:
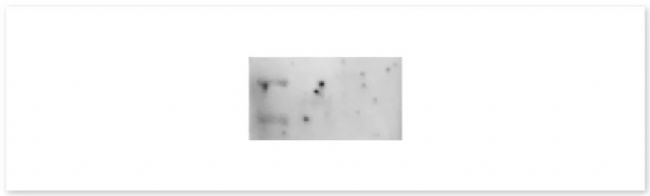
可能性原因:封闭液未完全溶解,使不容颗粒附着在膜上从而导致发光时候膜上形成黑点;或抗体在膜上分布不均;
建议:封闭液一定要充分溶解,封闭结束之后要用 TBST 清洗三遍再加一抗;抗体孵育时保持摇动。
▐ 8. 条带空斑:

可能性原因:目的蛋白条带中间空白,周围背景正常。该现象可能是一抗二抗浓度过高,促使底物过快消耗,从而导致在进行化学发光时,底物耗尽形成空斑。
建议:可减少蛋白上样量;降低一抗和二抗浓度;或者稀释显影液。

通过本篇推文介绍,相信普通的难题已经难不倒你们了! 如果以上内容没有解决您的问题,欢迎大家在下方留言,小 M 欢迎大家积极交流实验中遇到的各种疑难问题~

|
Beta Actin Antibody HRP Conjugated 常用的内参抗体之一,可检测 Beta Actin 总蛋白的内源水平。 |
| 可检测 alpha-tubulin 总蛋白的内源水平,并不会与重组 β-tubulin 蛋白发生交叉反应。 |
|
该抗体可检测 c-Myc 总蛋白的内源水平。 |
|
HRP-conjugated AffiniPure Goat Anti-Mouse IgG H&L 鼠二抗,山羊来源的抗小鼠 IgG 抗体,用于小鼠背景下 WB、ELISA、IHC 实验。 |
| HRP-conjugated AffiniPure Goat Anti-Rabbit IgG H&L
兔二抗,山羊来源的抗兔 IgG 抗体,用于兔子背景下 WB、IHC-P、ELISA 实验。 |
|
Ultra High Sensitivity ECL Kit 飞克级别抗原检测,一抗稀释比可达释1:1000 至1:50000 倍。 Protease Inhibitor Cocktail, mini-Tablet (EDTA-Free) 在样品制备、保存中可增加蛋白稳定性。 |
MCE的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务。
参考文献:
[1] Kroon C, et.al. Blind spots on western blots: Assessment of common problems in western blot figures and methods reporting with recommendations to improve them. PLoS Biol. 2022 Sep 12;20(9):e3001783.
[2] Cui Y. Optimization of blocking conditions for fluorescent Western blot. Anal Biochem. 2020 Mar 15;593:113598.
[3] Begum H, et al. Western blotting: a powerful staple in scientific and biomedical research. Biotechniques. 2022 Jun;73(1):58-69.
[4] Mary Johnson. Materials and Methods ,Western Blot - Protocol, Troubleshooting, and Survey Results on Instruments and Reagents.
[5] Gilda JE, et al. Western Blotting Inaccuracies with Unverified Antibodies: Need for a Western Blotting Minimal Reporting Standard (WBMRS). PLoS One. 2015 Aug 19;10(8):e0135392.
[6] Sule R, et al. Western blotting (immunoblotting): history, theory, uses, protocol and problems. Biotechniques. 2023 Sep;75(3):99-114.
