E.coli宿主菌应用及其残留RNA质控
已知,大肠杆菌(E.coli)表达系统是分子量较小蛋白或结构相对简单蛋白表达的首选宿主,主要表达胰岛素、干扰素和白介素等细胞因子类药物,这些药物中宿主残留核酸和蛋白的含量需要严格控制。另外,在细胞和基因治疗等领域,E.coli宿主菌通常被用于起始原材料质粒DNA的制备。质粒DNA做为细胞治疗和基因治疗药物的中间品或终产品,其中RNA片段的残留可能会降低DNA产品纯度,还可能会对其品质和安全性等产生一定的干扰,因此需对质粒DNA样本中宿主菌残留RNA的含量加以限制。
采用经验证的发酵和纯化工艺虽然可以去除一部分宿主细胞RNA(HCR)等残留杂质成分,但产品中仍然可能会有HCR残留。为保障生产的临床级质粒DNA的纯度和生物学活性,HCR检测项目成为了生物制品生产工艺中重要的质量检测指标之一。
残留RNA法规监管要求
据了解,各监管机构在判定DNA产品纯度时,均会将宿主细胞RNA含量作为其中一项关键检测指标。
美国FDA中明确规定了质粒材料的质量标准:超螺旋DNA>85%,宿主细胞蛋白<1%,残留细菌DNA<1%(聚合酶链式反应测定),残留细菌RNA<1%(高效液相色谱法或凝胶法检测不到)。欧洲药品管理局(EMA)在《基因治疗药物产品的质量、非临床和临床方面的指导原则》中,提出应考虑宿主细胞残留RNA,以确定质粒纯度。《中华人民共和国药典》2020年版第三部人用基因治疗制品总论中规定,应建立基因治疗制品物理数量和生物数量的含量检测指标,可以通过诸如总颗粒数、感染性滴度或感染性颗粒数、基因组DNA/RNA或质粒DNA浓度等的检测来确定含量。
此外,2022年5月,国家药品监督管理局药品评审中心(CDE)发布的体内基因治疗产品要学研究与评价技术指导原则(试行)中也明确指出需对生产工艺引入的工艺相关杂质,如宿主细胞RNA等纳入产品质量标准进行控制。


残留RNA检测方法
已知,对于生物制品的起始原材料质粒DNA中的宿主菌RNA残留检测,通常采用20年版中国药典0541通则琼脂糖凝胶电泳法。此外,USP在今年4月发布了《mRNA疫苗质量分析方法-指南草案》(第二版),对于质粒DNA质量属性的测试中提到了:宿主细胞RNA检测可采用高效液相色谱或琼脂糖凝胶电泳法。
除了琼脂糖凝胶电泳和高效液相色谱法外,行业内还会采用定量逆转录PCR(RT-qPCR)和RNA荧光定量方法检测生物制品中的宿主细胞残留RNA。定量逆转录PCR法由于是通过设计特异性的引物和探针,从而可实现对待测样本中的宿主细胞残留RNA高度专一性扩增和精确定量,因此该方法得到了业内的广泛应用。
针对上述情况,翌圣生物自主研发了E.coli宿主细胞残留RNA检测试剂盒,采用逆转录PCR(RT-qPCR)原理,设计特异性的引物和探针,利用逆转录酶反应体系将待测样本中的残留RNA反转录成cDNA,再进行qPCR实验检测残留的总RNA含量。样本类型包括:使用E.coli宿主菌进行分子酶、重组蛋白等表达产物制备的样本,以及使用E.coli宿主菌进行扩增的质粒DNA类样本。不仅如此,我们还研发了与之配套使用的宿主细胞残留DNA样本前处理试剂盒、DNase试剂以及配套的自动化核酸提取仪器。
E.coli残留RNA检测Kit产品性能
- 符合法规:按照Chp、USP、ICHQ2(R2)等要求进行全面验证,性能符合中外法规标准;
- 保障品质:试剂盒原材料全自主研发,qPCR Mix等酶产品在超洁净酶工厂生产;
- 配合审计:保障试剂盒生产工艺稳定,批间差可控,有完善的审计文件;
- 灵敏度高:定量下限(LLOQ)可达1fg/μL水平;
- 专属性强:特异性检测E.coli细胞残留RNA,不受其他外源基因组DNA和RNA干扰。

参考文献:
[1]European Medicines Agency, 2019. Guideline on quality, non-clinical and clinical requirements for investigational advanced therapy medicinal products in clinical trials.
[2]中国药典委员会(ChPC).《中国药典》三部[S].北京:中国科学技术出版社,2020:542-543.
[3]《体内基因治疗产品药学研究与评价技术指导原则(试行)》,国家药品监督管理局药品审评中心,2022年5月。
[4]USP. Analytical Procedures for mRNA Vaccine Quality (Draft Guidelines).
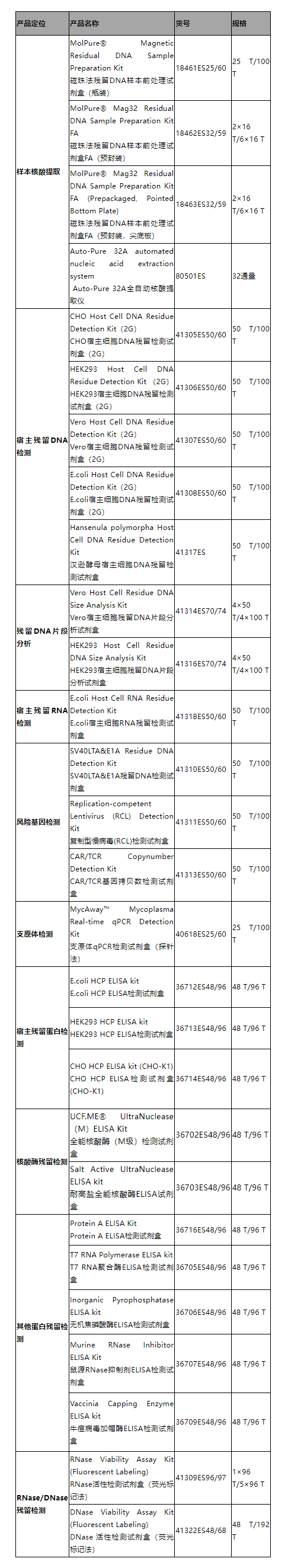
翌圣质控产品推荐