
发表时间:2022年2月14日
影响因子:IF = 27.401
文章链接:METTL14-mediated m6A modification of circORC5 suppresses gastric cancer progression by regulating miR-30c-2-3p/AKT1S1 axis
虽然胃癌 (Gastric Cancer, GC) 的发病率和死亡率在世界范围内呈下降趋势,但GC仍然是中国癌症相关死亡的第三大原因。近几十年来,GC治疗方式迅速发展,如内镜下切除、靶向治疗和免疫治疗。但是,由于肿瘤侵袭和转移,晚期患者的预后仍然很差。因此,了解肿瘤发生的分子机制对GC的早期诊断和治疗具有重要意义。
N6-甲基腺苷 (m6A) 是真核mRNA中最常见的化学修饰之一,在癌症发生发展中起着关键作用。m6A甲基化可以被甲基转移酶催化,如METTL3/14/16 ("writers"),被去甲基化酶去除, 如FTO和ALKBH5 ("erasers"),并与m6A结合蛋白相互作用,如YTHDF1/2/3和IGF2BP1/2/3 ("readers")。过往研究已经表明,METTL14在结直肠癌 (CRC),膀胱癌和乳腺癌中起肿瘤抑制剂的作用,而在甲状腺癌,胰腺癌和白血病的发生发展中则是致癌因子。目前,METTL14 在GC 中的作用在很大程度上仍不为人所知。
环状RNA (circRNA) 作为非编码RNA的一个亚群,其特征在于闭环结构和对RNase R的抗性。越来越多的证据表明,circRNA可以作为miRNA海绵来调节癌症进展,circRNA也通过这一机制在GC中起作用。我们之前的研究表明,circLARP4和circYAP1抑制了GC的生长,而circDLST则促进了其进展。但是,circRNA 在GC中的作用机制是否有 m6A 修饰的参与仍然未知。
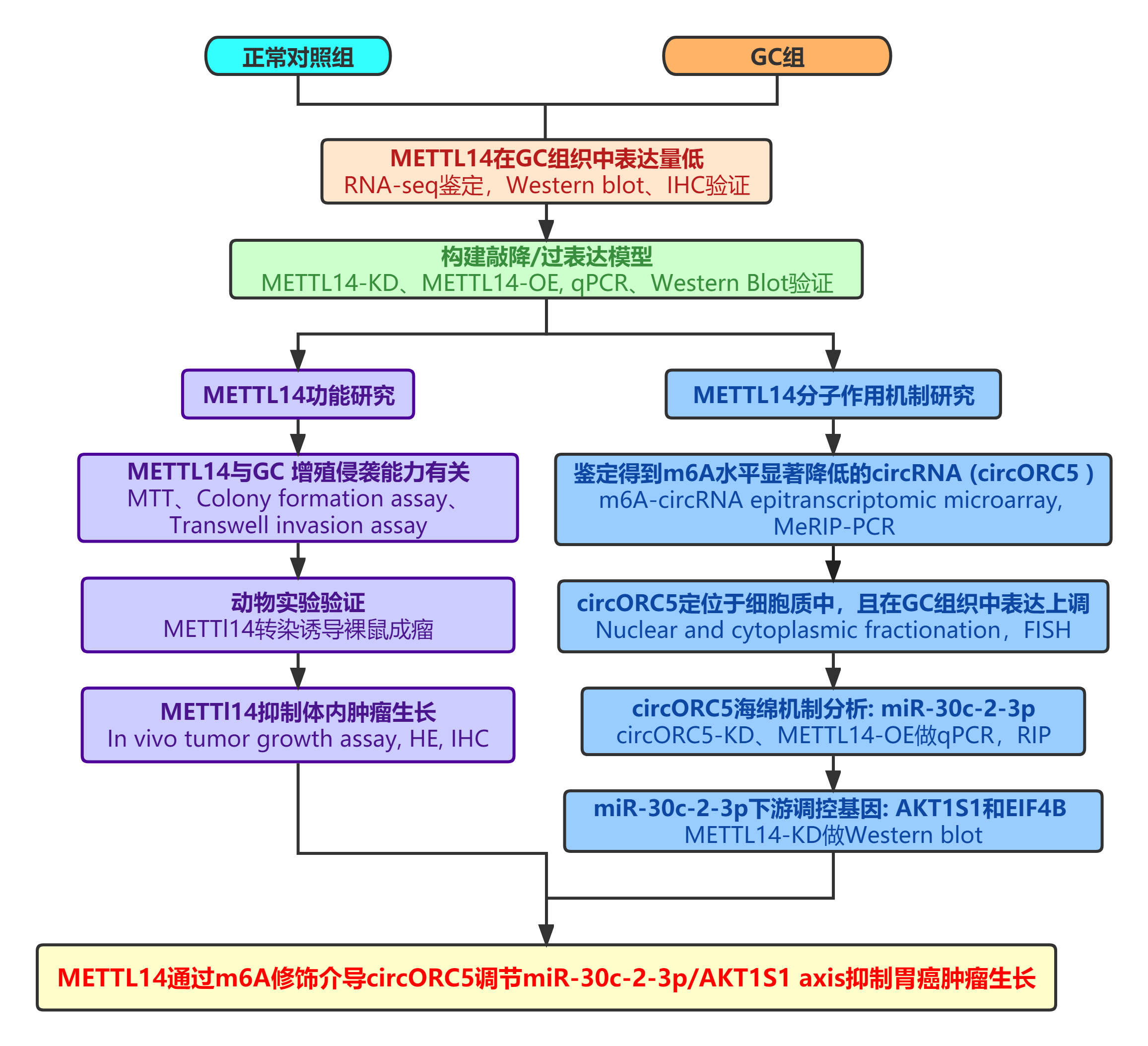
01 METTL14的下调与GC患者生存不良有关
作者首先分析了TCGA中的RNA-seq数据,并发现在人类GC组织中 METTL14的表达量相对于正常组织降低 (图1A)。研究者们通过Western blot进一步检测了10个配对的GC组织样品中METTL14的蛋白质水平,结果表明与成对的正常样品相比,METTL14在GC中的表达量显著下调 (图1B,C)。进一步采用IHC染色法分析了含有90对GC和正常组织的组织芯片, 验证了METTL14在GC组织中的下调性 (图1D)。此外,Kaplan-Meier分析发现,与高METTL14表达的患者相比,低METTL14表达的患者总生存期较差 (图1E)。同时,研究者们通过从GSE22377中提取TCGA和GC患者的临床数据,建立了独立的两个队列。与KM分析的结果一致,低METTL14表达的GC患者具有更差的生存率 (图1E)。综上所述,METTL14可以很好地反映GC患者的预后。
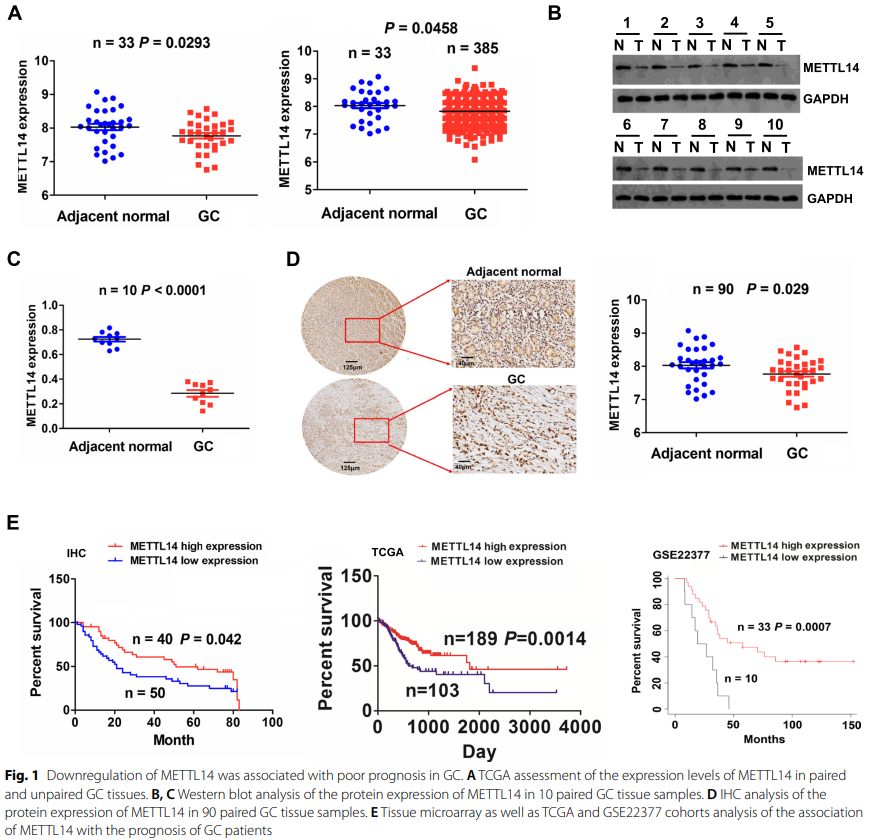
02 METTL14的敲降促进了GC的增殖和侵袭
鉴于METTL14在GC组织中的表达下调,作者推测METTL14可能在GC中起肿瘤抑制作用。研究者们通过RT-qPCR和Western blot检测了正常胃上皮细胞系 (GES1) 和GC细胞系 (SGC-7901,MKN28,BGC-823,AGS和MGC-803) 中METTL14的mRNA和蛋白质水平,发现METTL14在AGS和MGC-803中高表达,但在SGC-7901中低表达 (图2A)。因此,为了确定METTL14在GC中的作用,研究者们用siRNA在AGC和MGC-803细胞中建立了METTL14-敲降 (METTL14-KD) 细胞模型,用质粒在SGC-7901细胞中建立了METTL14过表达 (METTL14-OE) 细胞模型,并通过RT-qPCR和Western blot测定了转染效率 (图2B)。然后,作者通过MTT和colony formation assay评估了GC细胞的细胞活力和增殖能力。正如预期的那样,METTL14的敲降显著促进了细胞活力 (图2C) 和增殖潜力 (图2D)。此外,Transwell invasion assay表明,METTL14的下调极大地促进了GC细胞的侵袭能力 (图2E)。同样的,相对于对照组,过表达的METTL14对细胞活力 (图2C),集落形成 (图2D) 和入侵能力 (图2E) 表现出抑制作用。
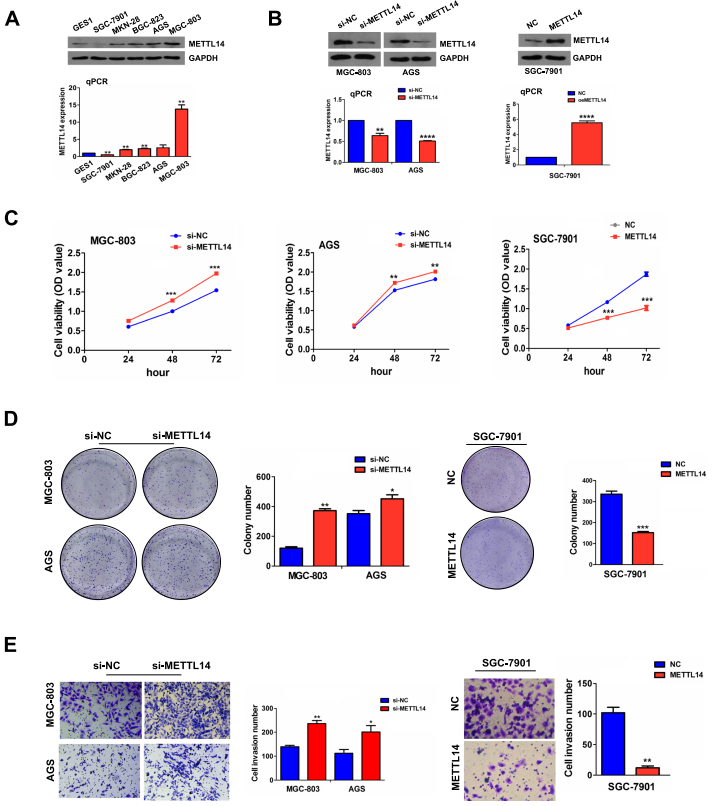
03 METTL14通过对circORC5的m6A修饰起作用
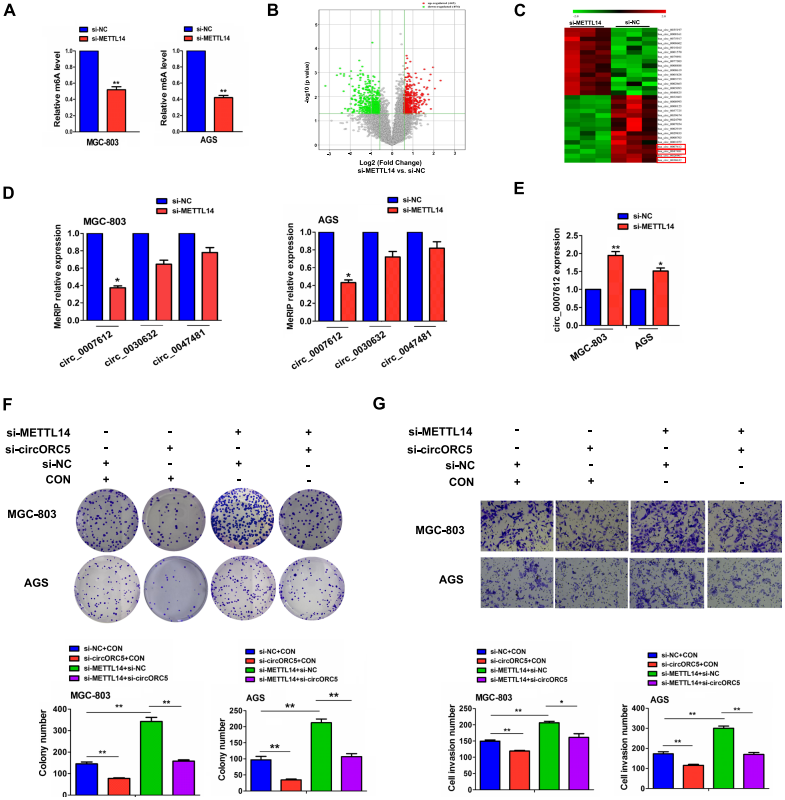
为了阐明 METTL14 在GC进展中的作用机制,研究者们首先通过m6A整体水平检测了MGC-803和AGS细胞中METTL14对m6A水平上的影响,结果表明在METTL14-KD的MGC803和AGS细胞中,m6A水平显著降低 (图3A)。然后,对m6A环状RNA 进行MeRIP高通量筛选,显示与对照组相比,METTL14-KD的MGC-803细胞中有444个circRNA的m6A水平增加,454个circRNA的m6A水平降低 (图3B)。其中,hsa_circ_0030632、hsa_circ_0047481和hsa_circ_007612是METTL14-KD细胞中m6A水平下调排名前三的circRNA (图3C)。 MeRIP-qPCR 进一步验证了hsa_circ_0007612 (circORC5) 的m6A水平在METTL14-KD细胞中降低 (图3D),而RT-qPCR分析表明,circORC5 的mRNA水平在METTL14-KD细胞中升高 (图3E)。在功能上,作者发现在MGC-803和AGS细胞中,circORC5删除降低了集落形成和入侵能力,并抵消了si-METTL14诱导的集落形成和入侵潜力 (图3F,G)。这些结果表明,METTL14通过对circORC5的m6A修饰起作用。
04 circORC5定位于细胞质中,且在GC组织中表达上调
根据环状RNA相互作用组中的circRNA注释,hsa_circ_0007612来自线性基因起源识别复合物亚基5 (ORC5),称为circORC5 (图4A)。与线性ORC5相比,circORC5在用RNase R外切酶处理后具有更高的稳定性 (图4B)。 细胞质和核RNA分析表明,circORC5主要定位于MGC-803和AGS细胞的细胞质中 (图4C)。FISH进一步证实,circORC5的绿色荧光分布主要存在于GC的细胞质中 (图4D),并且circORC5在GC组织中的表达量与相邻的正常组织相比有所增加 (图4E)。
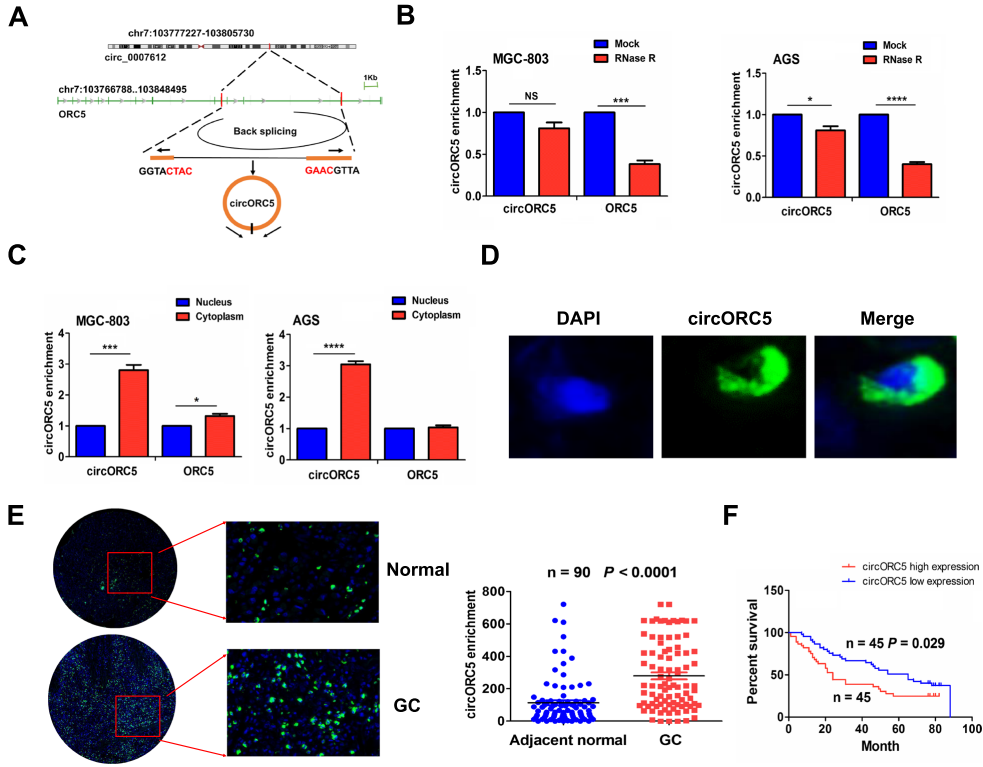
05 CircORC5在GC中与miR-30c-3p呈负相关
借助m6A-circRNA profling和miRbase,作者发现了五个miRNA具有与cirORC5结合的潜力 (图5A)。研究者们分析了这5种miRNA在GC中的表达水平,发现miR-30c-2-3p的表达水平在387个未成对和41个成对的GC组织中具有最显著的下降 (图5B)。FISH分析进一步证实,miR-30c-2-3p的表达水平明显下调,且与GC组织中的circORC5的表达水平呈负相关关系 (图5C,D)。FISH分析还表明,circORC5也定位于GC组织的细胞质中 (图5E)。
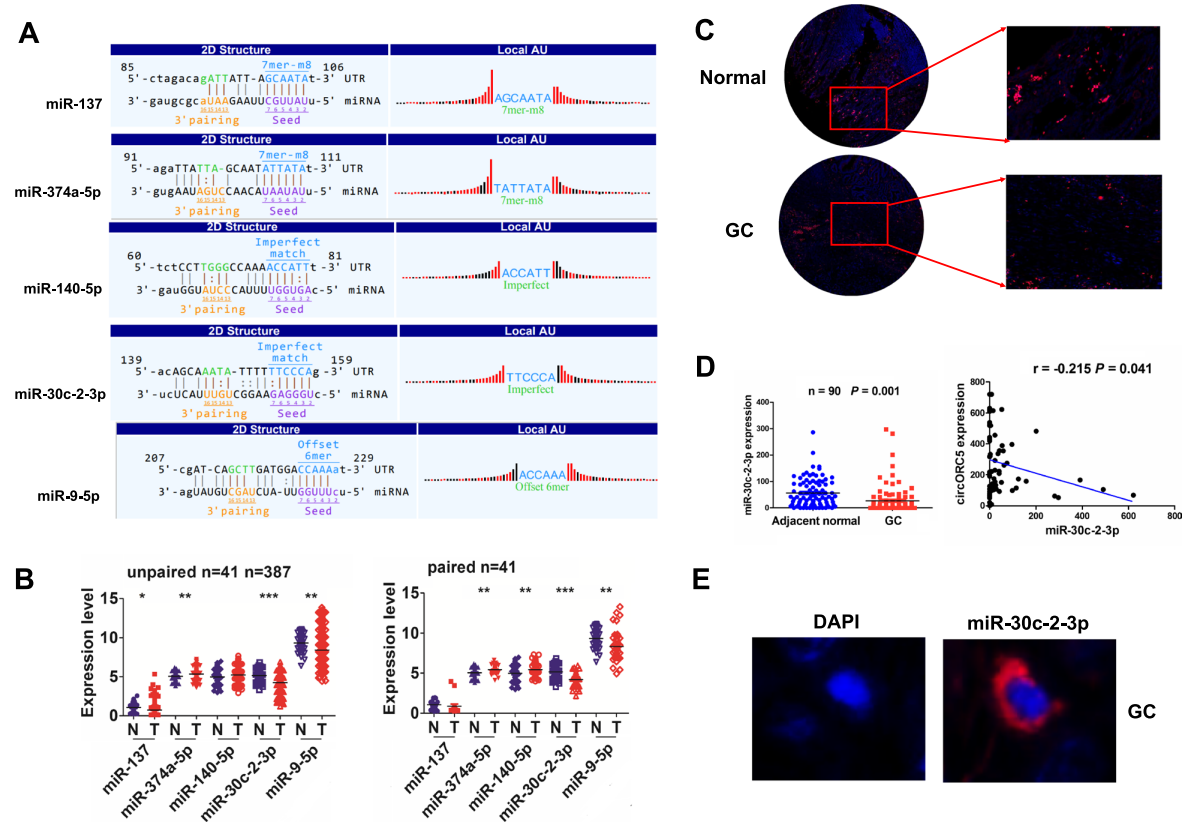
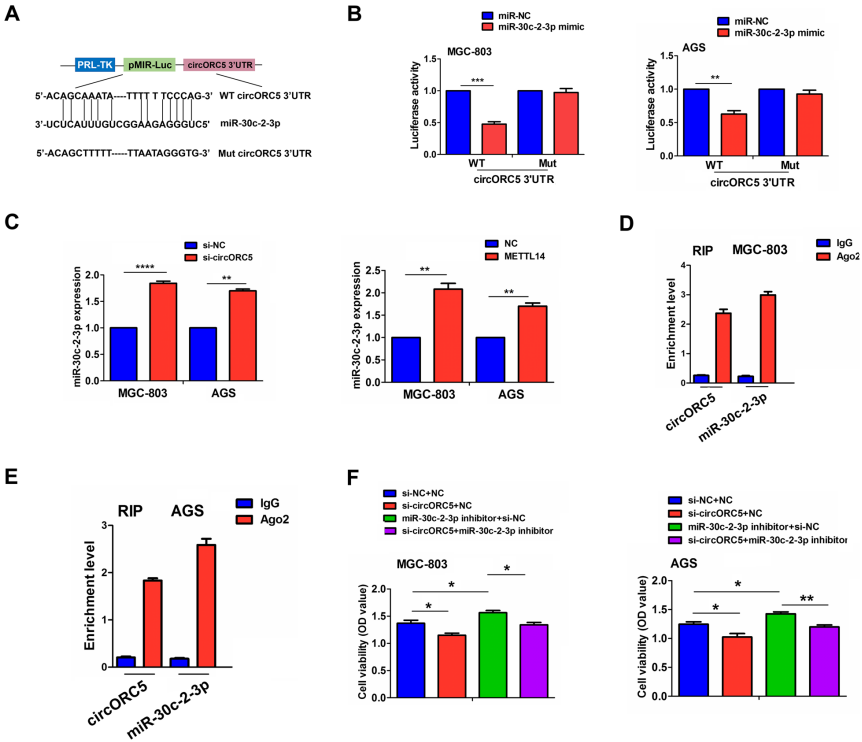
06 CircORC5在GC中充当miR-30c-2-3p的海绵
miR-30c-2-3p与circORC5的结合位点如图6A所示。作者发现miR-30c-2-3p模拟物可以降低野生型 circORC5 3'-UTR区的荧光素酶活性,但对突变体 circORC5 3'-UTR区的活性没有影响(图6B)。RT-qPCR分析表明,在MGC-803和AGS细胞中,通过敲降circORC5或过表达METTL14,miR30c-2-3p的表达量显著增加 (图6C),但miR-30c-2-3p模拟物对circORC5表达无影响。此外,研究者们在MGC-803和AGS细胞中对Ago2进行了RNA免疫沉淀 (RIP),并通过RT-qPCR分析研究了表达Ago2的细胞中circORC5和miR-30c-2-3p的内源性水平。结果表明与input对照相比,Ago2沉淀中的circORC5和miR-30c-2-3p富集 (图6D),进一步证实了circORC5在GC中充当miR-30c-2-3p的海绵。
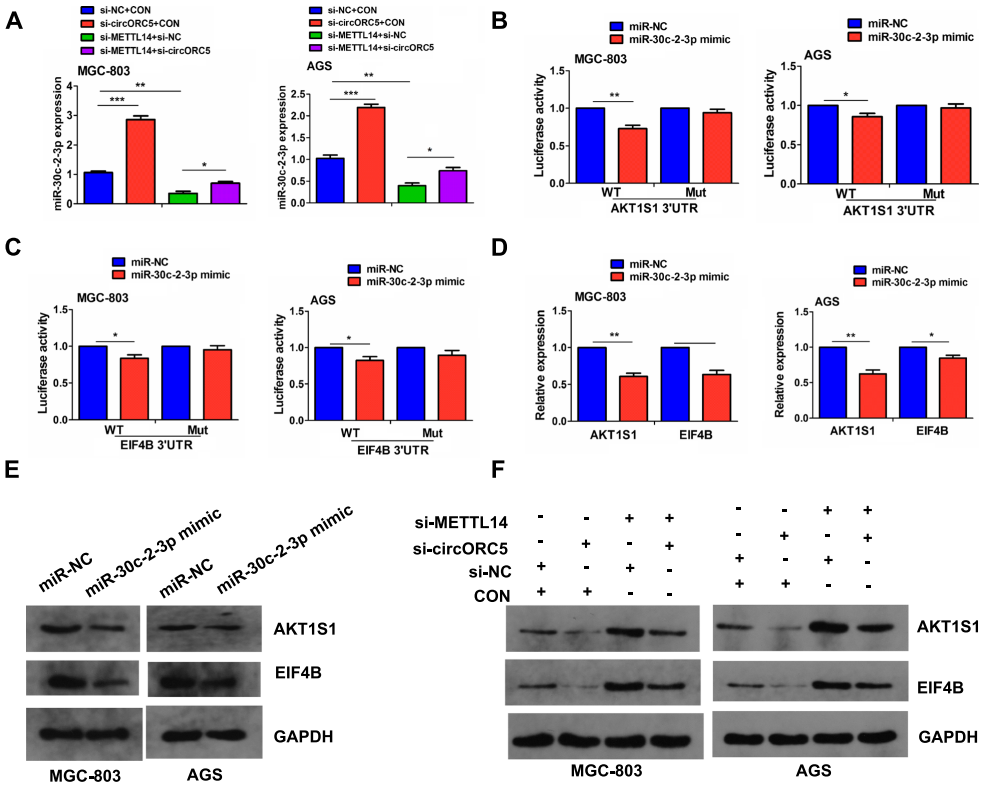
07 METTL14 介导circORC5 调节 miR-30c-2-3p/AKT1S1 axis
为了验证METTL14是否介导circORC5调节miR-30c-2-3p表达RT-qPCR分析表明,在MGC-803和AGS细胞中,circORC5的敲降增加了miR30c-2-3p表达,并逆转了METTL14敲降对miR-30c-2-3p表达的抑制作用 (图7A)。作者进一步发现,AKT1S1和EIF4B 是miR-30c-2-3p的目的基因,因为miR-30c-2-3p模拟物可以降低野生型AKT1S1和EIF4B 3' UTR区的荧光素酶活性(图7B,C)。同时,miR-30c-2-3p模拟物可以下调AKT1S1和EIF4B的表达 (图7D,E)。进一步的Western blot表明,METTL14敲降显著上调了MGC-803和AGC细胞中的AKT1S1和EIF4B表达,并且这种效果可以通过circORC5敲降逆转 (图7E)。
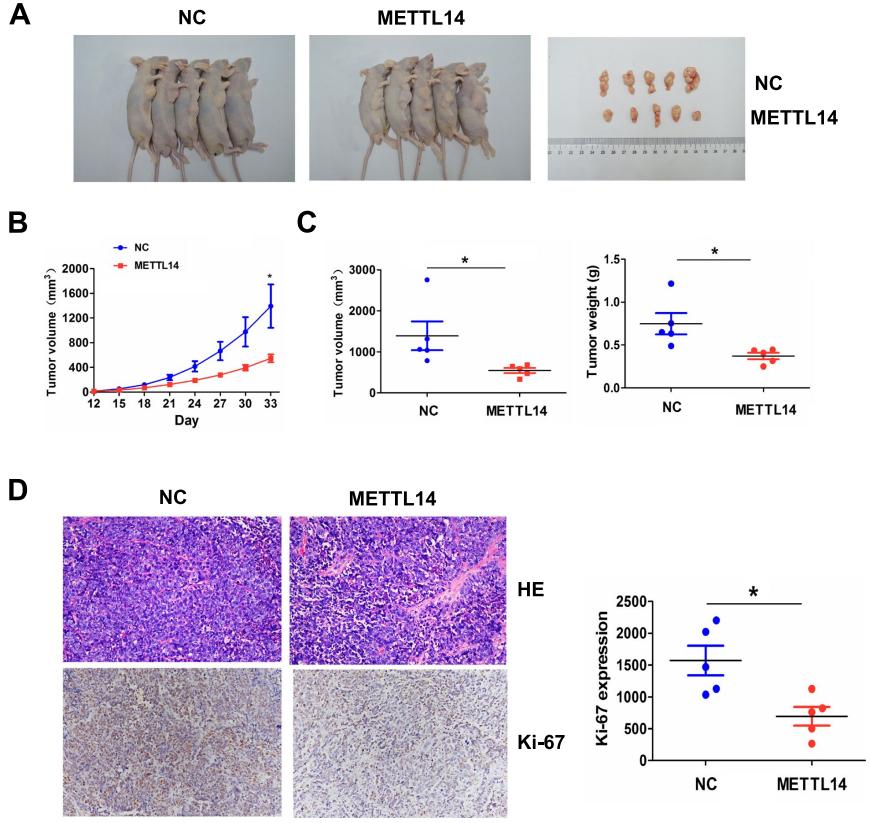
08 METTl14抑制体内肿瘤生长
为了阐明METTl14是否抑制了体内肿瘤的生长,研究者们将对照或METTl14稳定转染的SGC-7901细胞系注射裸鼠,成瘤后进行检测。研究发现METTl14转染SGC-7901细胞诱导的肿瘤体积小于对照组 (图8A)。而且生长曲线表明,METTl14转染组的肿瘤呈时间依赖性减小 (图8B),且与对照组相比,METTl14转染组肿瘤体积较小,重量较低 (图8C)。同时,HE和IHC检测表明,与对照组相比,METTl14转染组肿瘤增殖标志物Ki-67下调 (图8D)。综上所述,METTl14可抑制小鼠体内GC肿瘤生长。
本文以METTL14为研究对象,首先借助m6A-MeRIP高通量筛选和RNA-seq,筛选到下游环状RNA——circORC5,并进行了MeRIP-circRNA-PCR验证。然后通过数据库检索和RIP等实验发现circORC5可通过miRNA海绵机制直接结合miR-30c-2-3p,并调控下游基因AKT1S1和EIF4B的表达。随后通过功能探究发现METTL14可抑制胃癌肿瘤生长。总的来说,本文发现METTL14通过m6A修饰介导circORC5调节miR-30c-2-3p/AKT1S1 axis抑制胃癌肿瘤生长,并可能为GC提供潜在的治疗靶点。
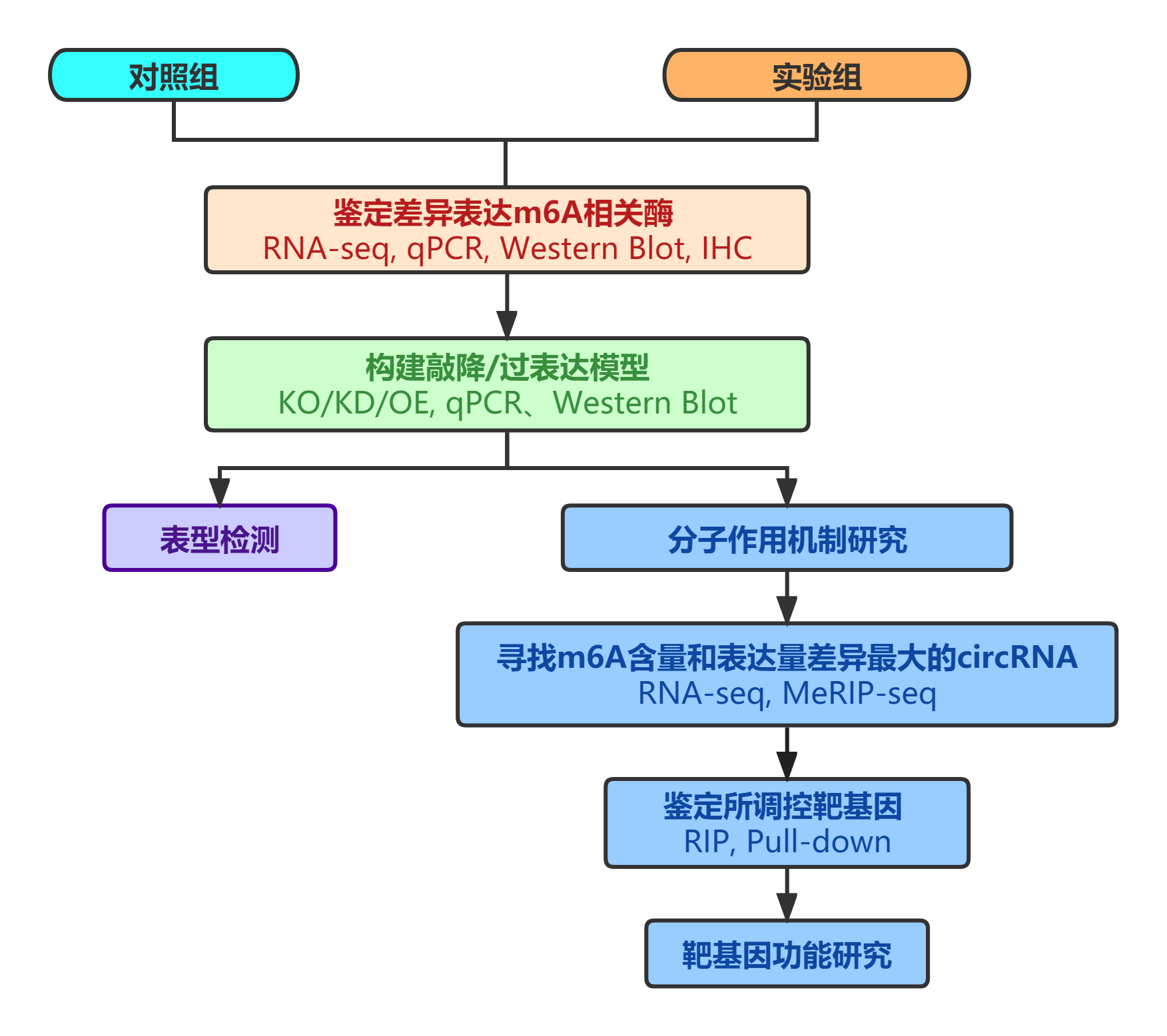
该文章为m6A甲基化修饰circRNA研究提供了典型的思路,从m6A修饰相关酶入手,寻找其在某一体系(疾病)中的异常表达情况,然后通过敲低和过表达该m6A修饰调控蛋白,进行表型检测和寻找m6A修饰差异化的circRNA进行进一步的分子机制研究。本公司可提供全面化的m6A修饰研究服务,更可借助目前最流行的m6A-MeRIP-seq技术高效筛选靶基因。
01 m6A RNA修饰测序
m6A RNA修饰测序(m6A-MeRIP-seq)
对m6A RNA甲基化,目前最流行的检测手段为m6A-Seq技术,适用于m6A RNA甲基化谱研究,快速筛选m6A RNA甲基化靶基因。云序可提供mRNA和多种非编码RNA的m6A测序:
- m6A 全转录组测序(涵盖mRNA,LncRNA,circRNA)
- m6A LncRNA测序(涵盖LncRNA和mRNA)
- m6A Pri-miRNA测序(涵盖Pri-miRNA和mRNA)
- m6A mRNA测序
- m6A miRNA测序
02 检测整体m6A RNA修饰水平
LC-MS/MS检测整体RNA修饰水平
精准高效,可以实现一次检测,9类修饰水平检测,一步到位。
比色法检测整体RNA修饰水平
快速检测m6A整体甲基化水平
03 m6A RNA修饰上游酶的筛选
m6A RNA修饰相关酶PCR芯片
寻找上游直接调控m6A RNA甲基化的甲基转移酶。
04 m6A RNA修饰靶基因验证
MeRIP-qPCR
云序提供各类不同修饰的meRIP-qPCR服务,可针对mRNA,lncRNA,环状RNA等不同类型的RNA分子进行检测,低通量验证RNA修饰靶基因表达水平。
05机制互作研究
RIP-seq/qPCR
筛选或验证RNA修饰直接靶点,研究RNA修饰靶基因的调控机制。
RNA pull down -MS/WB
筛选或验证目标RNA互作基因或蛋白,研究相应的分子调控机制。
双荧光素酶实验
验证两基因互作,研究相应的分子调控机制。
ChIP-seq
筛选或验证目标蛋白与DNA互作,研究相应的分子调控机制。
优势二:至今完成4000+例 m6A测序样本,全面覆盖医口、农口等各类样本。
优势三:全面检测mRNA和各类非编码RNA(circRNA,lncRNA,Pri-miRNA等)。
优势四:独家提供m6A一站式服务:m6A整体水平检测、m6A测序、MeRIP-qPCR验证、RIP和
上海云序生物科技有限公司 商家主页
地 址: 上海市松江区莘砖公路518号24号楼4楼
联系人: 戴小姐
电 话: 021-64878766
传 真: 021-64878766
Email:market@cloud-seq.com.cn;liuqingqing@cloud-seq.com.cn
