● 抗肿瘤
Science:发现常见维生素的免疫调节作用:高维生素D3饮食小鼠的粪菌移植增强了多个肿瘤模型中抗免疫阻断的效果,脆弱拟杆菌依赖维生素D促进抗肿瘤作用。
Nat Commun:核受体共活性4(NCOA4)可介导肿瘤细胞对奥希替尼Osi治疗迅速触发的耐药性抵抗,并引入了结合铜离子载体以提高其初始疗效。
Nature Cancer:肿瘤t6A水平受到微环境中苏氨酸浓度的动态调控,苏氨酸限制饮食有效降低血清苏氨酸浓度,抑制肿瘤t6A(tRNA第37位腺苷发生t6A修饰)和异常蛋白翻译,延缓肿瘤进程。
Nat Commun:致癌的纤维细胞生长因子受体2 (FGFR2)信号驱动了肝内胆管癌(ICC)中依赖于NFκB的糖酵解,抑制FGFR可通过代谢脆弱性治疗胆管癌。
PNAS:高脂饮食HFD相关的肠道微生物群通过激活多态核髓源性抑制细胞(PMN-MDSC)的产生来产生亮氨酸,从而促进癌症的进展。
● 代谢流
Nature Cancer:稳定同位素标记的苏氨酸,发现外源性苏氨酸干预在胶质母细胞瘤干细胞(GSC)中的含量升高,苏氨酸可调控肿瘤 t6A 水平。
Nat Commun: 利用同位素标记的葡萄糖代谢流揭示FGFR2信号刺激糖酵解基因表达和葡萄糖代谢重编程过程。
Cell Metab:稳定同位素示踪(代谢流)实验证实,在肺动脉外膜成纤维细胞(PAAFs)激活时,谷氨酰胺和丝氨酸的代谢增加。
导读目录
1.Science | 维生素D调节微生物群依赖性的癌症免疫
2.Nature Communications | 铁蛋白自噬介导非小细胞肺癌对EGFR酪氨酸激酶抑制剂的适应性抵抗
3.Cell Metabolism | 5:2间歇性禁食方案通过肝脏PPARα和PCK1改善NASH和纤维化并减缓HCC的发展
4.Nature Cancer | 苏氨酸通过YRDC介导的密码子偏倚翻译重编程为胶质母细胞瘤提供燃料
5.Nature Communications | FGFR抑制阻断NF-ĸB依赖的葡萄糖代谢并赋予胆管癌代谢脆弱性
6.Cell Metabolism | 膳食摄入和靶向谷氨酰胺-丝氨酸代谢可控制病理性血管僵硬
7.Nature | 耐力运动训练多组学反应的时间动态
8.PNAS | 高脂肪饮食通过诱导肠道菌群介导的亮氨酸产生和PMN-MDSC分化来促进癌症进展
资源领取
本期导读文献原文,请在公众号后台回复“2024年5月绘谱导读”,即可获取资源链接。
01
Science | 维生素D调节微生物群依赖性的癌症免疫

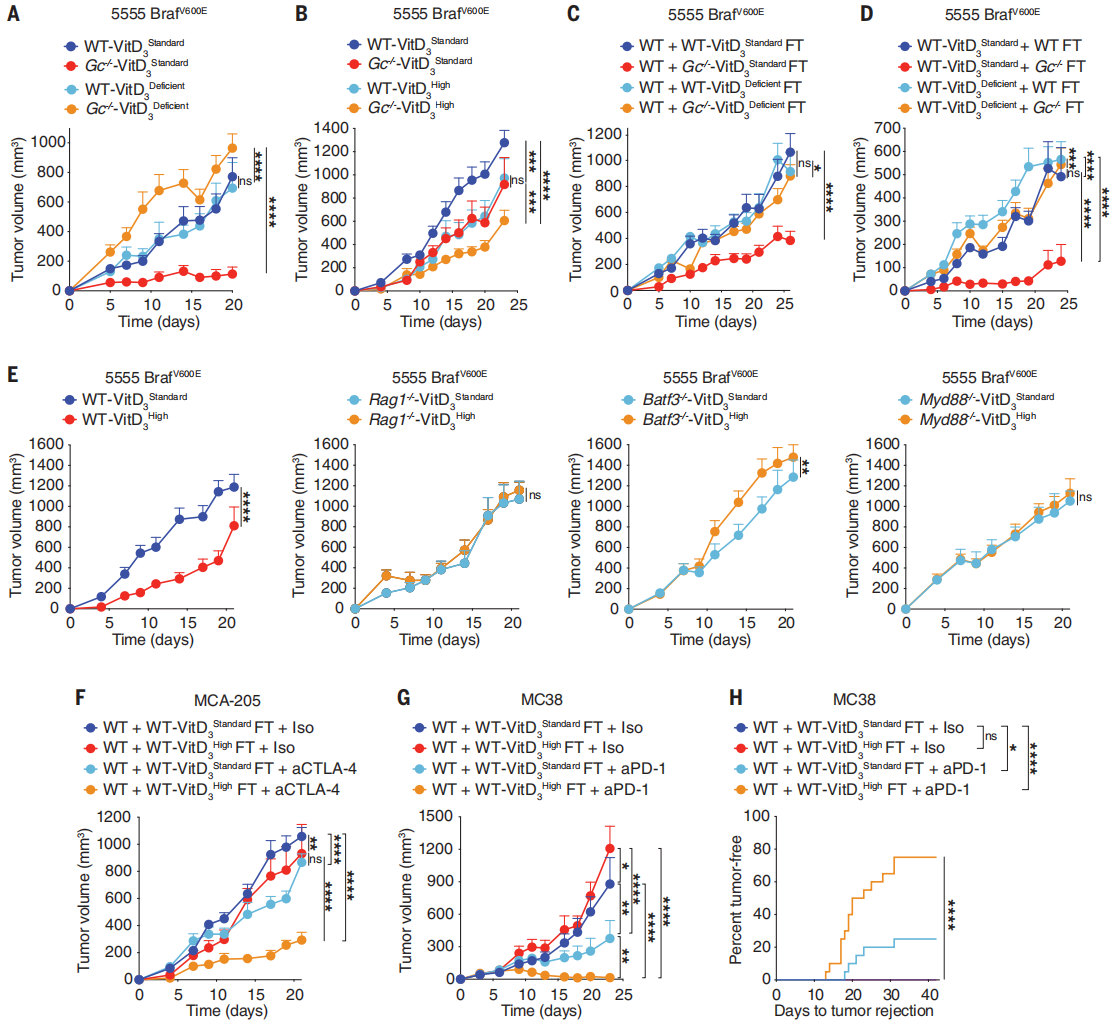
维生素D被报道具有抗癌作用,在免疫调节和微生物群落中扮演重要角色,但其活性影响癌症发展的程度以及是否涉及免疫系统和/或微生物组,目前还尚不清楚。本研究通过展示维生素D和微生物共生群落对肿瘤的免疫响应之间的新联系,发现并强调了维生素D是癌症免疫和治疗的潜在决定因素。
● 1. 已知Gc球蛋白是维生素D及其代谢物的结合蛋白,研究通过构建模型小鼠发现Gc的缺失可增加CD8 T细胞依赖性肿瘤的控制并增强了对免疫治疗的反应。来自Gc−/−小鼠的粪便移植可增强抗癌免疫力,而移植到缺乏T细胞和B细胞的小鼠后保护作用消失,表明Gc−/−微生物群赋予的肿瘤抗性具有免疫依赖性。
● 2. 靶向代谢组学分析发现Gc−/−小鼠血浆中维生素D3及其代谢产物25-羟基维生素D3(25-OHD3)水平较低。喂食高维生素D3饮食小鼠的粪菌移植增强了多个肿瘤模型中抗免疫阻断的效果,表明Gc的缺失通过改变肠道微生物组来增加维生素D依赖性的抗癌免疫力。随后转录组测序等方法证实了这种调控由肠道上皮中的维生素D受体来介导。
● 3. 宏基因组学结果提示较高的维生素D可用性增加了脆弱拟杆菌的丰度,随后证实了脆弱拟杆菌以维生素D依赖性的方式促进肿瘤抗性。基于不同癌种的人群队列研究同样表明,临床维生素D水平与肿瘤发生和患者存活率相关。
参考文献
Giampazolias E, Pereira da Costa M, Lam KC, et al. Vitamin D regulates microbiome-dependent cancer immunity. Science. 2024
02
Nature Communications | 铁蛋白自噬介导非小细胞肺癌对EGFR酪氨酸激酶抑制剂的适应性抵抗

奥希替尼(Osi)是一种广泛使用的表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI),然而其耐药性的出现限制了其在临床上的疗效与应用,部分原因是适应性耐药细胞在初始治疗期间逐渐进化。本研究通过代谢组学及一些列体内外实验发现核受体共活性4(NCOA4)可介导肿瘤细胞对Osi治疗迅速触发的耐药性抵抗,并引入了结合铜离子载体以提高其初始疗效的新疗法。
● 1. 通过构建肿瘤小鼠模型和体外细胞培养实验,发现Osi治疗可迅速诱导肿瘤细胞的适应性耐药性。代谢组学分析发现氧化磷酸化(OXPHOS)在适应性抗性细胞中发生了显著的改变,并进一步通过线粒体相关实验证实了适应性抗性细胞依赖于活性的OXPHOS。
● 2. 转录组测序和定量PCR均揭示了Osi处理可诱导肿瘤细胞中(NCOA4,铁蛋白自噬的关键蛋白)升高。进一步证实了NCOA4介导的铁蛋白吞噬在适应性耐药的肿瘤细胞中被激活,而敲除NCOA4显著降低了Osi胁迫下铁硫簇(ISC)蛋白和OXPHOS的合成、抑制Osi在体内外的自适应抗性的形成,表明NCOA4在治疗适应性耐药性中的核心作用。
● 3. 研究发现,适应性抗性细胞中的活性ISC蛋白合成能显著提高对铜离子的敏感性,因此将Osi与低浓度的铜离子离子载体—elesclomol结合使用,发现肿瘤细胞的适应性耐药性被显著抑制,Osi的初始疗效得到提高,且不会产生额外的毒性。

参考文献
Wang H, Hu Q, Chen Y, et al. Ferritinophagy mediates adaptive resistance to EGFR tyrosine kinase inhibitors in non-small cell lung cancer. Nature Communications. 2024
03
Cell Metabolism | 5:2间歇性禁食方案通过肝脏PPARα和PCK1改善NASH和纤维化并减缓HCC的发展

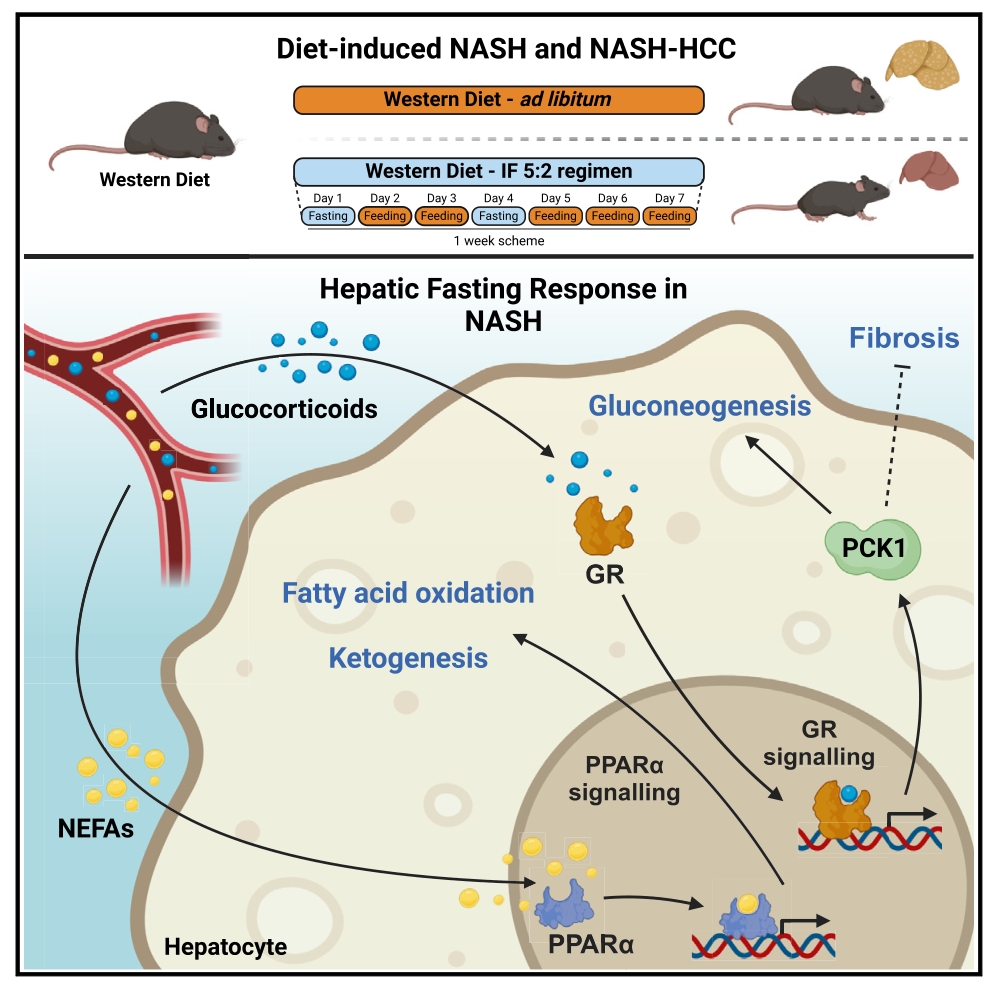
NAFLD(非酒精性脂肪肝病)被认为是代谢综合征在肝脏中的表现,可发展为非酒精性脂肪性肝炎(NASH)和肝硬化,一部分NASH患者可发展为肝细胞癌(HCC)。间歇性禁食(IF)在NASH及其向HCC转变中的作用和分子机制尚不清楚。本研究发现IF 5:2方案在不影响总热量摄入的情况下可以预防NASH的发展以及改善已建立的NASH和纤维化。此外,结合蛋白质组学、转录组学和代谢组学分析发现,过氧化物酶体增殖因子激活受体α (PPARα)和糖皮质激素信号诱导的PCK1可作为禁食反应的主要执行者共同作用。
● 1. 对小鼠的肝脏匀浆进行蛋白质组学分析,发现糖异生关键酶、脂肪酸氧化相关酶和生酮限速酶在禁食期间均显著升高,而参与新生脂肪生成的关键酶在禁食期间显著下调,且禁食小鼠的脂肪酸代谢和PPAR信号通路显著富集,进一步证实PPARα是禁食反应的中心调节剂。
● 2. 对小鼠肝脏进行代谢组学分析发现,禁食诱导肝酮体3-羟基丁酸显著增加,葡萄糖和乳酸降低,再饲喂时基本逆转,通路分析进一步显示, 空腹期间糖酵解、Warburg效应和丙酮酸代谢受到抑制,脂肪酸代谢和牛磺酸/次牛磺酸代谢显著富集。
● 3. 转录组学分析进一步发现,禁食反应并不完全由PPARα协调,而是涉及多个转录因子和激素的复杂相互作用,如糖皮质激素(GCs)和糖皮质激素受体(GR)信号。
参考文献
Gallage S, Ali A, Barragan Avila JE, et al. A 5:2 intermittent fasting regimen ameliorates NASH and fibrosis and blunts HCC development via hepatic PPARα and PCK1. Cell Metabolism. 2024
04
Nature Cancer | 苏氨酸通过YRDC介导的密码子偏倚翻译重编程为胶质母细胞瘤提供燃料

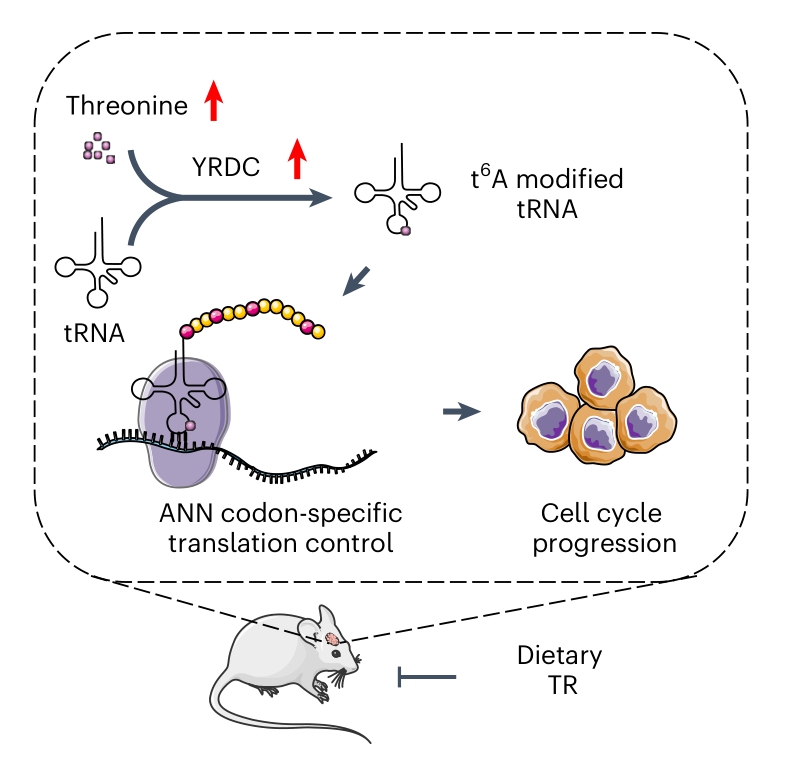
胶质母细胞瘤(GBM)是最常见的原发性恶性脑肿瘤,治疗手段和效果非常有限,胶质母细胞瘤干细胞(GSC)的存在是导致其疗效不佳的重要原因之一。该研究通过CRISPR等技术发现GSC同时上调YRDC表达和下调苏氨酸分解代谢,促进tRNA第37位腺苷发生t6A修饰,导致整体翻译加速。肿瘤 t6A 水平受到微环境中苏氨酸浓度的动态调控,通过苏氨酸限制饮食可有效降低血清苏氨酸浓度,抑制肿瘤 t6A和异常蛋白翻译,延缓肿瘤进程。
● 1. 转录组学数据分析发现, tRNA修饰酶的表达存在差异。具体来说,19种酶在GSCs中富集,17种酶在GBM中富集,而YRDC是GSCs和GBM中均上调的两种酶之一。
● 2. 质谱分析显示, 靶向YRDC可减少tRNA上的t6A,降低GSCs的存活率,阻碍蛋白翻译,抑制肿瘤生长。缺乏YRDC的GSCs表现出较慢的翻译速率。
● 3. 使用稳定同位素标记的苏氨酸([13C4,15N]L-苏氨酸)追踪苏氨酸6小时,发现在GSCs中约有30%的苏氨酸标记为t6A,在DGCs中标记水平较低。进一步通过质谱分析t6A水平,发现补充苏氨酸可以在不影响总腺苷水平的情况下提高t6A水平,而饮食限制降低了t6A。
参考文献
Wu X, Yuan H, Wu Q, et al. Threonine fuels glioblastoma through YRDC-mediated codon-biased translational reprogramming. Nature Cancer. 2024
05
Nature Communications | FGFR抑制阻断NF-ĸB依赖的葡萄糖代谢并赋予胆管癌代谢脆弱性

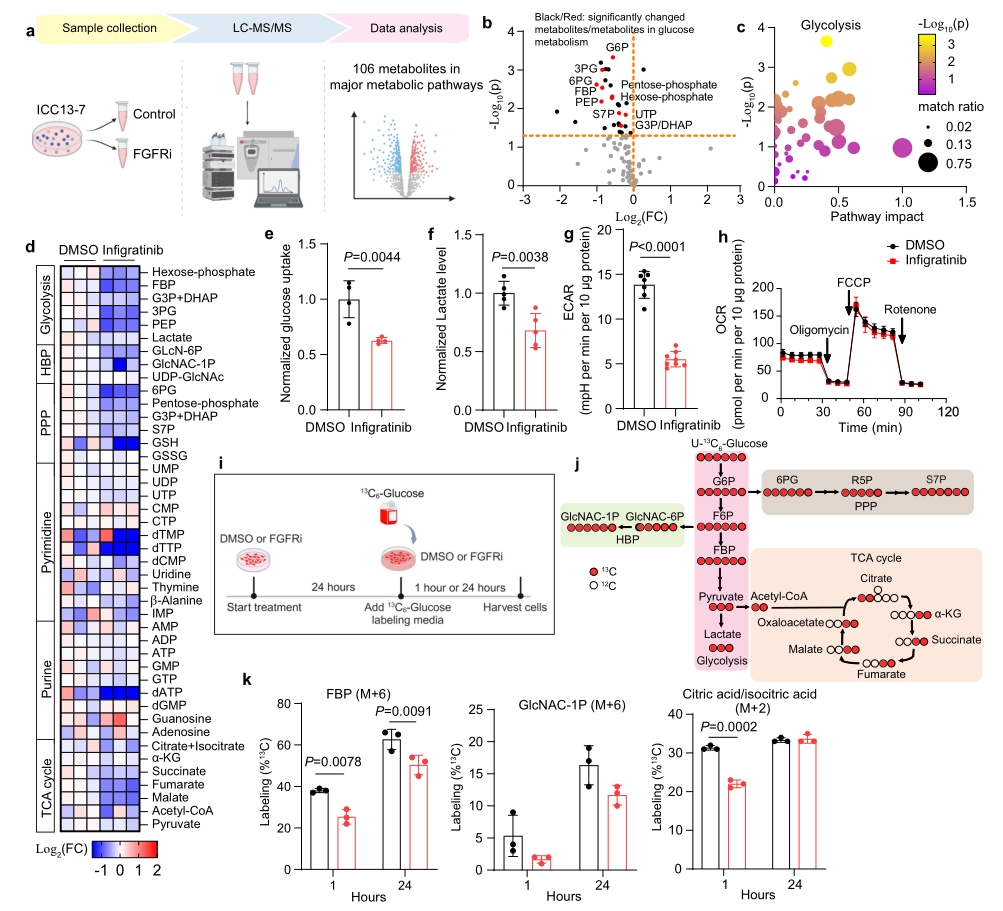
肝内胆管癌(ICC)中常见一类激活成纤维细胞生长因子受体2 (FGFR2)的基因组改变,这类患者对FGFR抑制剂治疗的预后较好。然而介导FGFR2信号致癌活性的关键下游靶标和生物细胞学过程仍未知。本研究通过转录组学、代谢组学和磷酸化蛋白质组学研究,发现致癌的FGFR2信号驱动了ICC中依赖于NFκB的糖酵解,而对FGFR抑制反应的代谢重新编程赋予了新的靶向脆弱性。
● 1. 转录组测序结果显示,FGFRi治疗显著下调了糖酵解的基因表达:其对糖酵解中第一限速酶的己糖激酶2 (HK2)表现出强烈的抑制作用,且其他参与糖酵解的基因也协同下调,而TCA循环有关基因没有改变。该结果表明,FGFR抑制可以有效抑制FGFR2融合+ICC模型中糖酵解基因的表达。
● 2. 代谢组学检测发现,FGFRi处理24h后,葡萄糖代谢中间体广泛下调,富集分析显示糖酵解是变化最大的通路。随后利用13C6-glucose进行代谢流研究,结果发现M+2标记的柠檬酸/异柠檬酸、苹果酸和α酮戊二酸(α-KG) 显著减少,这表明进入TCA循环的葡萄糖流量也减少。以上结果表明FGFR2信号刺激糖酵解基因表达和葡萄糖代谢重编程,以支持FGFR2融合+ICC的生长。
● 3. 磷酸化蛋白质组学从3954种蛋白中检测到19136个磷酸化位点,蛋白通路分析表明,FGFRi处理后NF-κB通路成分的磷酸化显著减少。在进一步的机制研究中发现,FGFR2-MEK介导的NF-κB激活是维持高度活化的葡萄糖代谢和支持FGFR2融合+ICC模型生长所必需的。
● 4. 通过联合抑制FGFR和线粒体氧化代谢等实验进一步提示,抑制FGFR会导致葡萄糖代谢受损,限制ICC细胞的适应性,并在体外和体内产生靶向代谢脆弱性。
参考文献
Zhen Y, Liu K, Shi L, et al. FGFR inhibition blocks NF-ĸB-dependent glucose metabolism and confers metabolic vulnerabilities in cholangiocarcinoma. Nature Communications. 2024
06
Cell Metabolism | 膳食摄入和靶向谷氨酰胺-丝氨酸代谢可控制病理性血管僵硬

在心血管疾病中,活化的血管成纤维细胞促进了胶原蛋白合成,使得血管僵硬。例如,在肺动脉高压(PH)中,在疾病早期阶段可发现外膜成纤维细胞被激活。然而,除了糖酵解之外,活化的肺动脉外膜成纤维细胞(PAAFs)的代谢需求还不清楚。本研究发现转录共激活因子YAP/TAZ通过调控谷氨酸和丝氨酸代谢来促进胶原蛋白合成,是影响血管纤维化和硬化的主要途径,并且可以通过药物或饮食干预脯氨酸和甘氨酸的合成需求,可以减少血管硬化并改善心血管功能。
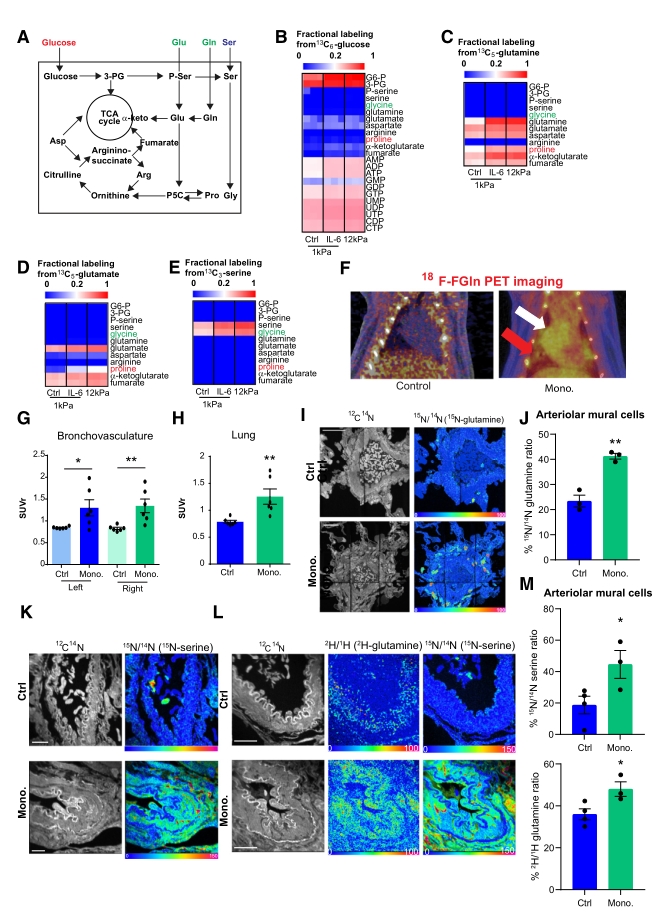
● 1. 代谢组学检测发现,PAAFs的激活会显著改变细胞与脯氨酸和甘氨酸代谢相关的途径。稳定同位素示踪(代谢流)实验证实:在PAAF激活时,谷氨酰胺和丝氨酸的代谢增加,并且这些氨基酸合成的脯氨酸和甘氨酸水平上升。此外,使用18F标记的谷氨酰胺(18F-FGln)结合正电子发射断层扫描(PET)成像技术,观察到激活的PAAFs增加对谷氨酰胺和丝氨酸的摄取,这些氨基酸作为脯氨酸和甘氨酸合成的底物,进而促进胶原蛋白的合成和PH中的血管硬化。
● 2. 随后研究者试图确定这些氨基酸代谢的调控因子,并根据已有报道锁定了转录因子YAP和TAZ。通过Chip-seq分析TEAD(YAP和TAZ的转录因子)的结合位点,发现其控制谷氨酰胺/脯氨酸和丝氨酸/甘氨酸代谢相关的基因。敲除YAP和TAZ的小鼠模型证实了这两个转录因子在体内对血管纤维细胞的代谢和胶原重塑活动具有协调作用。
● 3. 最后通过对单羧胺处理的大鼠使用GLS1和SHMT1的抑制剂进行试验,确定了药理学手段靶向谷氨酰胺和丝氨酸代谢可减少血管硬化并改善PH的肺血管功能;此外还发现通过饮食限制谷氨酰胺和丝氨酸的摄入也可改善PH。
参考文献
Rachedi NS, Tang Y, Tai YY,et al. Dietary intake and glutamine-serine metabolism control pathologic vascular stiffness. Cell Metabolism. 2024
07
Nature | 耐力运动训练多组学反应的时间动态

定期锻炼有助于促进全身健康并预防疾病,但其潜在的分子机制尚不完全清楚。本文通过时间多组学和多组织分析揭示了对耐力训练适应性反应的广泛生物学见解,包括免疫、代谢、应激反应和线粒体途径的广泛调节。许多变化与人类健康有关,包括非酒精性脂肪性肝病、炎症性肠病、心血管健康和组织损伤和恢复。
● 1. 对6个月大的雄性和雌性大鼠进行1、2、4或8周的渐进式跑步机耐力运动训练,通过基因组学、蛋白质组学、代谢组学和蛋白质免疫分析技术对全血、血浆和18种组织进行检测分析。
● 2. 转录学结果表明,在血液中,观察到造血相关转录因子GABPA、ETS1、KLF3和ZNF143富集;在心脏和骨骼肌中,观察到一簇富集的Mef2家族转录因子基元,MEF2C是一种与肌肉相关的转录因子,参与骨骼、心脏和平滑肌细胞的分化,并与血管发育、心环形成和神经元分化有关。
● 3. 与其他组织相比,肝脏在染色质可及性方面表现出显著的调控,包括在核受体信号传导和细胞衰老途径中。腓肠肌中,在蛋白质水平上,与过氧化物酶体增殖激活受体(PPAR)信号传导和脂质合成与降解相关通路富集,由包括脂滴特征蛋白PLIN2、PLIN4和PLIN5在内的蛋白质驱动;在代谢组学水平上,醚脂和甘油磷脂代谢通路富集。
● 4. 代谢组学结果表明,肝脏中显著富集的代谢物种类最多,其次是心脏、肺和海马;1-甲基组氨酸(肌肉蛋白转换的标志)在1、2和4周时在肾脏中上调,这可能表明在早期训练时间点肌肉分解和通过肾脏的清除;肾脏的皮质醇水平大幅增加,这可能也是由于肾脏清除所致;肝脏在8周时显示1-甲基烟酰胺的上调,这可能与炎症有关。

参考文献
MoTrPAC Study Group; Lead Analysts; MoTrPAC Study Group. Temporal dynamics of the multi-omic response to endurance exercise training. Nature. 2024
08
PNAS | 高脂肪饮食通过诱导肠道菌群介导的亮氨酸产生和PMN-MDSC分化来促进癌症进展

高脂肪饮食(HFD)是通过破坏肠道微生物群导致癌症恶性进展的高风险因素,然而,与HFD相关的肠道微生物群在癌症发展中的作用仍不清楚。本研究发现在乳腺癌和黑色素瘤模型中,HFD相关的肠道微生物群通过激活多态核髓源性抑制细胞(PMN-MDSC)的产生来产生亮氨酸,从而促进癌症的进展。
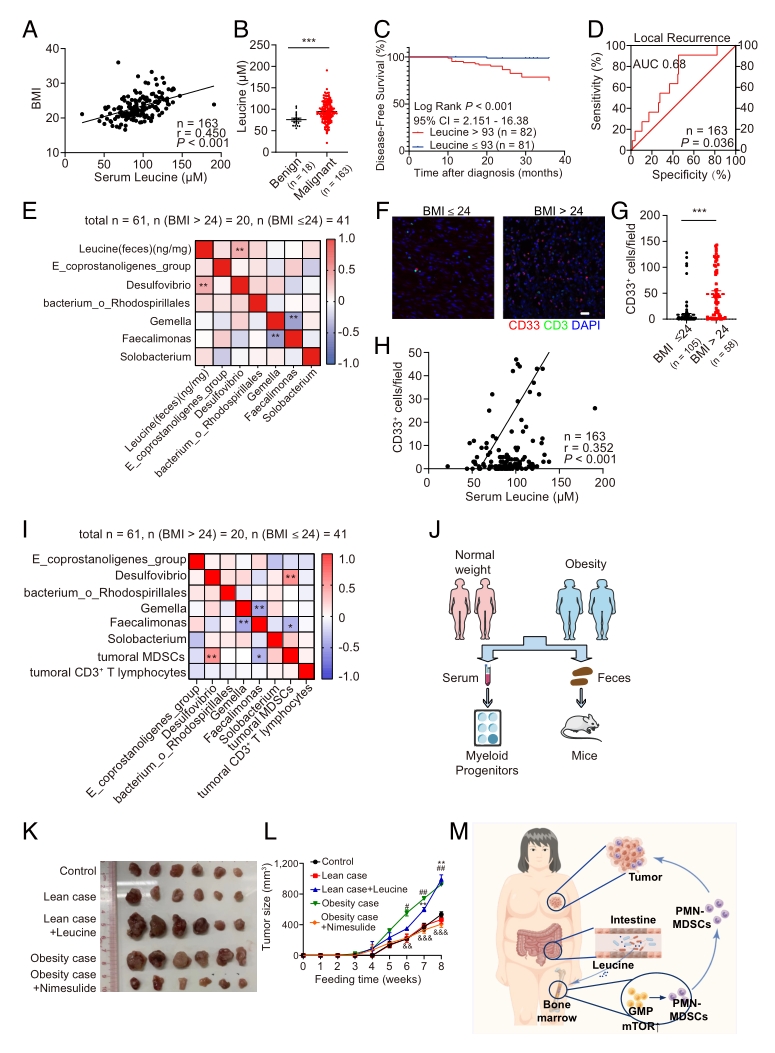
● 1. 对61例女性乳腺癌患者粪便样本进行16S rRNA基因测序表明,BMI > 24的患者Desulfovibrio的丰度与肿瘤大小和Ki67(肿瘤生长速度的指标)阳性呈正相关。
● 2. 通过流式细胞术检测发现,与NFD组相比,HFD组和HDFMT组小鼠肿瘤内和循环中的PMN-MDSCs均显著升高,并且PMN-MDSCs水平的增加在抗生素治疗后被逆转。
● 3. 与NFD小鼠的血清相比,HFD或HDFMT小鼠的血清都促进了MP细胞向MDSCs的分化,尤其是PMN-MDSC。
● 4. 靶向代谢组学结果表明,HFD小鼠粪便中支链氨基酸(BCAAs)水平,包括L-亮氨酸、L-缬氨酸和L-异亮氨酸,显著高于NFD粪便;HFD和HDFMT组血清亮氨酸、异亮氨酸和缬氨酸浓度显著高于NFD组;缬氨酸、异亮氨酸和亮氨酸的生物合成是最显著上调的代谢途径。
● 5. 乳腺癌患者血清亮氨酸与BMI和肿瘤Ki67水平呈正相关;与良性肿瘤携带者相比,乳腺癌患者血清亮氨酸水平明显升高;乳腺癌患者的粪便亮氨酸水平与Desulfovibrio属呈正相关。
参考文献
Chen J, et al. A high-fat diet promotes cancer progression by inducing gut microbiota-mediated leucine production and PMN-MDSC differentiation. PNAS. 2024.
END
