分子诊断技术因其优异的检测灵敏度和特异性在众多检测技术中脱颖而出,但常见的液体诊断试剂存在运输成本高、保质期短等问题,使其应用受到一定限制。随着市场需求及技术的不断发展、创新,冻干形式的分子诊断检测试剂应运而生。相比起传统液体检测试剂来说,冻干产品的优势包括以下几点:
- 常温稳定——三维结构固定,可保证酶和反应体系在常温下稳定,无需冷链运输和冰箱、冷库保存,可延长产品保质期;
- 使用简便——无需反复冻融、分液等操作;
- 降低成本——无需冷链运输和冷冻保存,可有效降低运输和储存成本;
- 高精密度——一次反应使用一个冻干微芯,减少试剂配制时的成分误差,缩短操作时间,防止配液过程生物活性的损失,从根本上提升精密度;
- 使用灵活——不受样本量限制,一个样本也可上机。
传统的分子酶或预混液往往含有高浓度的甘油作为冷冻保护剂和稳定剂,但试剂中的甘油会破坏水的结构导致水分难以去除,从而影响冻干产品的结构和稳定性,因此冻干时要优先选择不含甘油的试剂。此外,在那些对试剂成分敏感的应用(如数字PCR)中,使用高浓度无甘油分子酶可以进一步降低甘油对数字PCR反应的影响,同时扩大数字PCR检测试剂体系优化的空间。
翌圣无甘油分子酶解决方案
翌圣已建立完善的无甘油分子酶研发、生产平台,通过物料、环境、工艺、过程、质量等多环节把控,目前已实现多种无甘油分子酶的规模化生产。
透析工艺小试
将固定体积的甘油酶进行透析工艺优化:
1、筛选不同分子酶最适的透析液;
2、筛选不同分子酶稳定性储液,使其能够在4℃或者-20℃环境下长期储存。
切向流过滤工艺放大
根据透析工艺小试过程可确定最适透析buffer成分,以及其最适储存液,后续可采用切向流过滤工艺(也称UFDF)进行溶液buffer的置换。
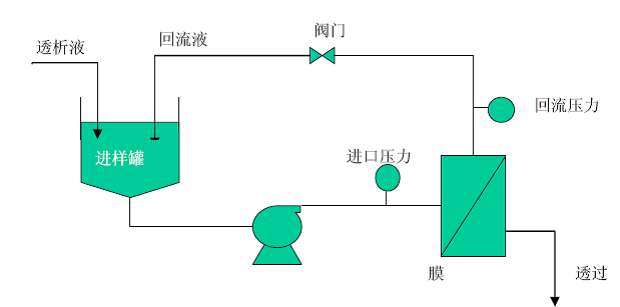
图1.切向流过滤系统原理示意图
切向流过滤工艺开发关键在于储存液配方、洗滤液配方、过滤环节中跨膜压和流速的选择。翌圣已建立标准的切向流过滤工艺的工艺流程,可根据目标分子酶甘油含量要求,快速确定洗滤体积和时间参数,节约物料成本和时间成本。
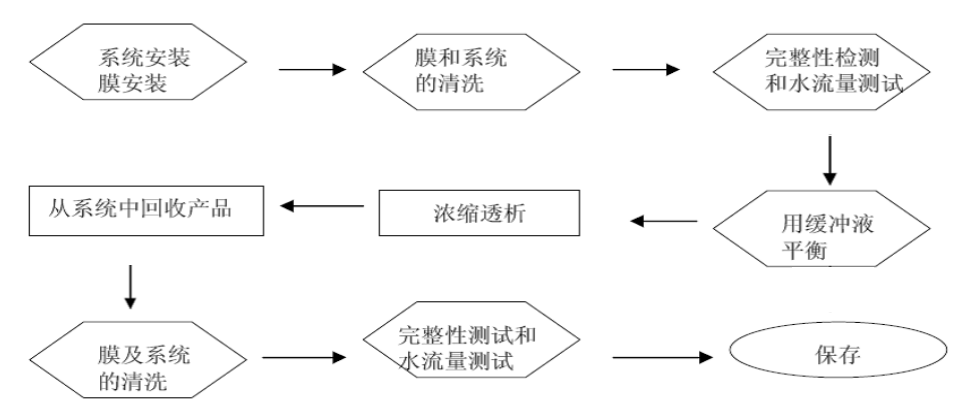
图2.切向流过滤系统实验流程
质量控制
以上多个制备工艺可以应对不同体量、不同产品制备需求,为评估各种工艺间、同一工艺批次间的产品的稳定性,翌圣也建立了对应的性能参数表征系统,可以从多维度评估无甘油酶的效果,表征方法包括蛋白测定、酶活测定(回收率)、甘油含量、保护剂含量测定、酶应用性能评估等。
翌圣无甘油分子酶产品
翌圣通过ZymeEditor™酶改造平台对qPCR/RT-qPCR、LAMP/RT-LAMP、RPA、NGS建库等全套分子酶进行改造,同时使用无甘油分子酶制备工艺对含甘油的分子酶进行处理,目前可规模化提供适用于qPCR/RT-qPCR,LAMP/RT-LAMP的无甘油分子酶原料,在满足诊断检测便于冻干需求的同时,依然能保持与液体体系同样的质量和性能。
表1.翌圣无甘油分子酶产品清单

部分数据展示
无甘油分子酶产品:37℃加速54天性能稳定
使用Yeasen 14316ES和对应的含甘油酶分别配制成qPCR预混液,同时扩增105、104、103copies/mL的模板。结果显示无甘油酶14316ES和对应含甘油酶扩增效果一致。将无甘油酶13705ES置于37℃进行稳定性测试,结果显示经过37℃ 54天加速处理后,其扩增性能与未加速对照结果一致。以上结果表明无甘油分子酶性能与甘油酶无差异,且稳定性好。
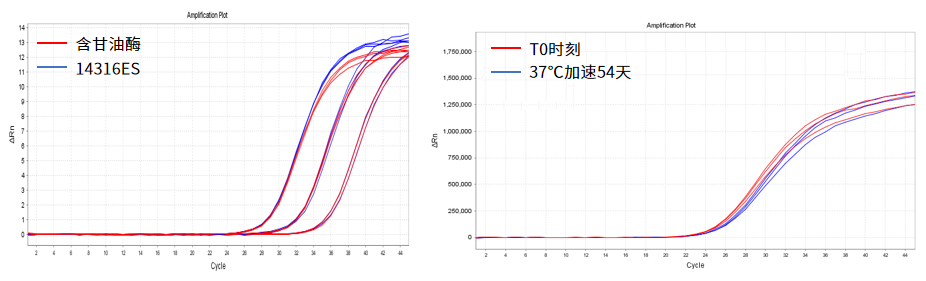
图3.无甘油分子酶产品测试数据
RT-qPCR冻干产品:50℃加速25天,冻干品形态和性能稳定
使用Yeasen 13705ES配制成RT-qPCR预混液,冻干后进行50℃加速25天稳定性测试,同时扩增105、104、103 copies/mL的新冠假病毒模板。结果显示:冻干品加速前后产品形态、Ct值和荧光值均无显著变化,冻干产品稳定性良好。
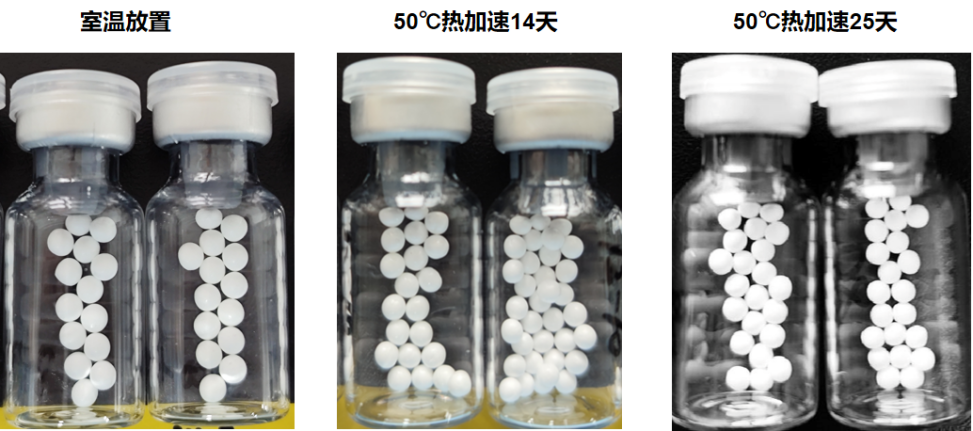
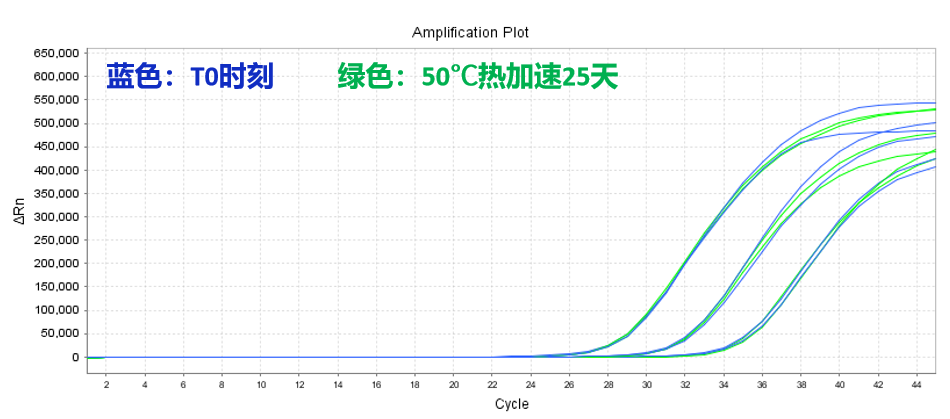
图4.RT-qPCR冻干产品加速稳定性测试数据
RT-LAMP冻干产品:45℃加速30天,冻干品形态和性能稳定
使用Yeasen 14405ES搭配11297ES配制成RT-LAMP预混液,冻干后进行性能测试,阳性反应孔为橙黄色,阴性反应孔为洋红色,反差极大,结果判读明显。此外,冻干后产品在45℃加速30天后形态无明显变化。结果显示:冻干品冻干后产品形态及性能稳定。


图5.RT-LAMP冻干产品测试数据
