溶酶体β-半乳糖苷酶染色试剂盒(Lysosomal β-Galactosidase Staining Kit)是一种对溶酶体中酸性β-半乳糖苷酶(Acid β-Galactosidase)进行染色检测的试剂盒,常用作细胞衰老检测时的对照。在普通的光学显微镜下就可以观测到细胞或组织中溶酶体酸性β-半乳糖苷酶的活力水平情况。本试剂盒可以用于培养细胞的检测,也可以用于组织切片的检测。
绝大多数正常细胞都可以检测到较高水平的溶酶体β-半乳糖苷酶活性水平。可以用作细胞衰老β-半乳糖苷酶染色时的参考染色。细胞衰老特异的β-半乳糖苷酶仅在衰老时表达,而溶酶体β-半乳糖苷酶几乎在任何情况下都表达。
溶酶体β-半乳糖苷酶染色试剂盒,以X-Gal为底物,在溶酶体酸性β-半乳糖苷酶的催化下会生成深蓝色产物。从而在光学显微镜下很容易观察到变成蓝色的表达β-半乳糖苷酶的细胞或组织。本产品染色后的HeLa细胞请参考图1。
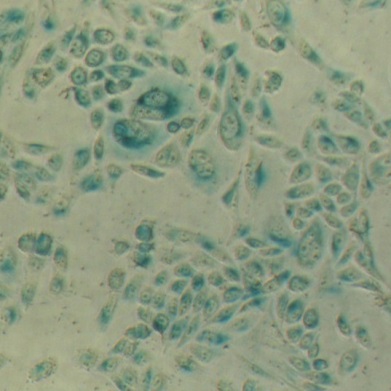
图1. HeLa细胞使用本产品染色后的示例图片。
本试剂盒仅染色溶酶体酸性β-半乳糖苷酶,不会染色衰老特异性的β-半乳糖苷酶,也不会染色外源转染表达的用于报告基因的β-半乳糖苷酶(大肠杆菌的β-半乳糖苷酶)。
主要特点:本试剂盒经过多方面的优化,是同类产品中首创的能兼容普通的细胞培养用多孔板、移液管等聚苯乙烯类材质耗材或容器的试剂盒。本试剂盒可以有效避免由于和多孔板、移液管等的不兼容导致的染色偏弱、染色效果不稳定等情况。通常同类试剂盒要求使用可高温高压灭菌的聚丙烯(polypropylene)材质的耗材、容器或玻璃容器进行溶液的配制,而不能使用普通的多孔板、移液管等聚苯乙烯(polystyrene)类材质的容器或耗材,否则可能会出现絮状沉淀,影响实验观察。即使严格按照要求操作,也会在染色时间比较长的情况下,容易出现絮状物沉淀(参考图2)。本试剂盒经过多方面的优化,对耗材或容器的材质无特殊要求,可以兼容普通的多孔板和移液管等常用耗材和容器。而且配制的工作液不会产生沉淀或不溶物,使用更加便捷。
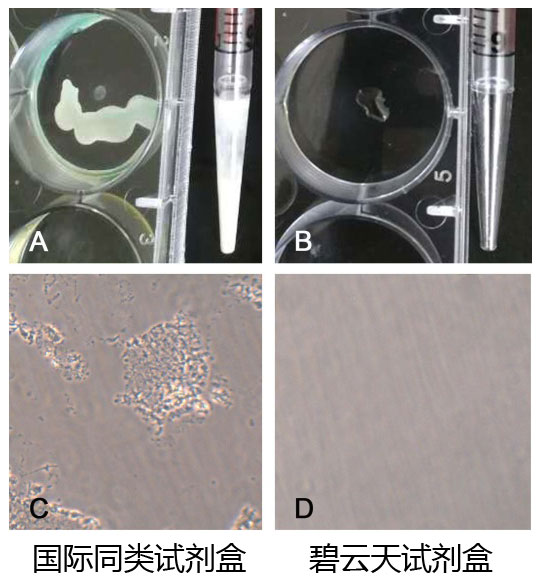
图2. 本试剂盒优化前后的对比图。优化前,X-Gal溶液直接接触聚苯乙烯类材质的材料如移液管、多孔板等会产生明显的腐蚀(A图),使用聚苯乙烯容器配制染色工作液后,在显微镜下观察有异常的絮状不溶物(C图);优化后,X-Gal溶液直接接触聚苯乙烯类材质的材料观察不到有任何异常情况(B图),使用聚苯乙烯容器配制染色工作液后,在显微镜下观察也没有任何异常情况(D图)。
如果使用6孔板检测,足够测定100个样品;使用24孔板测定,足够测定400个样品;使用96孔板测定,足够测定1000个样品。对于组织切片或组织块,可以检测的样品数量视样品的大小而定。对于普通切片的滴染足够检测100个样品。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| C0605-1 | β-半乳糖苷酶染色固定液 | 100ml |
| C0605-2 | X-Gal溶液 | 5ml |
| C0605-3 | β-半乳糖苷酶染色液A | 1ml |
| C0605-4 | β-半乳糖苷酶染色液B | 1ml |
| C0605-5 | β-半乳糖苷酶染色液C | 100ml |
| - | 说明书 | 1份 |
保存条件:
-20℃保存,一年有效。其中X-Gal溶液需避光保存。
注意事项:
β-半乳糖苷酶染色固定液对人体有毒、有腐蚀性,操作时请特别小心,并注意有效防护以避免直接接触人体或吸入体内。
X-Gal溶液在-20ºC或4ºC保存会冻结,室温或37ºC水浴2-5分钟并适当摇动即可完全融解。
β-半乳糖苷酶染色液B在刚刚溶解后会观察到有沉淀,属正常现象,充分混匀或Vortex后,沉淀会全部溶解。作为常规,试剂使用前必须确保沉淀全部溶解,并且混匀。
使用96孔板等多孔板进行检测时,如果孵育过夜容易产生所谓的“边缘效应”(edge effect),即多孔板四周的孔由于和外界最直接接触,易受外界环境影响,其中最明显的是四周细胞培养孔的蒸发效应。边缘效应会导致细胞生长不均匀、细胞分布不均一、培养液体积不一致、培养液中相关成分的浓度、pH值不一致。建议采取以下方法避免96孔板等多孔板的边缘效应:避免孵育过长时间,以避免蒸发等带来的边缘效应;弃用边缘孔并在弃用的边缘孔中加入等量的水、PBS或其他适当溶液;在多孔板非孔的凹陷处加入适量的水或其他适当溶液;将整块板放在湿盒中;使用防挥发盖;在实验设计时,实验样品最好进行随机分配,不要将某一组样品固定放在某个位置而引入可能的系统性误差。
需自备PBS或HBSS(Hanks Balanced Salt Solution)。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1. 对于贴壁细胞:
a. 对于6孔板中培养的细胞,吸除细胞培养液,用PBS或HBSS洗涤1次,加入1毫升β-半乳糖苷酶染色固定液,室温固定15分钟。对于其它类型的培养板,固定液及后续溶液的用量参照此比例进行操作。
b. 吸除细胞固定液,用PBS或HBSS洗涤细胞3次,每次3分钟。
c. 吸除PBS或HBSS,每孔加入1毫升染色工作液。染色工作液的配制方法参考表1。
表1. 染色工作液的配制方法。
| β-半乳糖苷酶染色液A | 10μl |
| β-半乳糖苷酶染色液B | 10μl |
| β-半乳糖苷酶染色液C | 930μl |
| X-Gal溶液 | 50μl |
d. 37℃孵育过夜,可以用parafilm或保鲜膜封住6孔板防止蒸发。
e. 普通光学显微镜下观察。如不能及时观察计数,可以去除染色工作液,加入2毫升PBS,4℃可以保存数天;或者加上封片液封片后,4℃可以保存较长时间。
2. 对于悬浮细胞:
a. 离心收集细胞至1.5ml离心管内,用PBS或HBSS洗涤1次,加入1毫升β-半乳糖苷酶染色固定液,室温固定15分钟。固定时可以在摇床上缓慢摇动,以避免细胞结成团块。
b. 离心,吸除细胞固定液,用PBS或HBSS洗涤细胞3次,每次3分钟。
c. 离心,吸除PBS或HBSS,每管加入0.5-1毫升染色工作液。染色工作液的配制方法参考表1。
d. 37℃孵育过夜。
e. 取部分染色后的细胞,滴加到载玻片上或6孔板内,普通光学显微镜下观察。如不能及时观察计数,可以离心,去除染色工作液,然后加入1毫升PBS,4℃可以保存数天。如果离心,取细胞用于涂片,加上封片液封片后,4℃可以保存较长时间。
3. 对于组织切片:
a. 对于石蜡切片先按照常规方法进行脱蜡和水化处理。对于冷冻切片直接按照以下步骤进行。
b. 加入适当体积的β-半乳糖苷酶染色固定液,以充分盖住组织为宜,室温固定不少于15分钟。
c. 用PBS浸泡洗涤组织3次,每次不少于5分钟。
d. 吸除PBS,加入适当量的染色工作液。染色工作液的配制方法参考表1。
e. 37℃孵育过夜,可以用parafilm或保鲜膜封住防止蒸发。最好把整个切片浸泡在染色工作液中。
f. 普通光学显微镜下观察。如不能及时观察,加上封片液封片后4℃可以保存较长时间
