周细胞怎么分离?找遍了百度也没有看到具体的protocol,不要急,看看我们技术整理的实践经验吧。
不用急,先把参考的文献步骤截个图
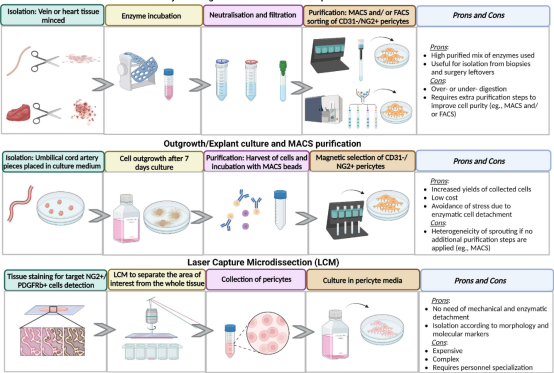
那么我们就进入正题吧
一.组织的处理
1.确保所有液体、容器、仪器和专用操作区域都是无菌的。
2.将组织样本(由组织库或手术团队采购)放入由冷冻的基础培养基的含20%胎牛血清(FBS)和2%青霉素-链霉素(P/S)冰上操作
3.从培养基中取出样品,并用由磷酸盐缓冲盐水(PBS)组成的洗涤介质洗涤,补充2%FBS和2%P/S。处理样品时,使用细尖镊子夹住大血管尽量减少对组织的挤压。
4.将样品浸泡在培养皿中的洗涤介质中,用消毒虹膜剪刀去除其他大血管和结缔组织
5.使用单侧剃须刀片或一把锋利的虹膜剪刀将剩余的组织切成约1 mm3的小块。
备注:如果立即处理样品,将获得最高的细胞产量。如果延迟是不可避免的,则将处理后的组织存储在新鲜存储介质(>5 ml/1 cm3组织)在4°C下持续72小时或者使用组织冻存液冻存一个月也能提取出来周细胞,但可能影响细胞产量。
二. 组织的消化和细胞的分离
1. 配制好消化溶液,使用DMEM配制各包含0.5mg/ml胶原酶I、胶原酶II和胶原酶IV,并在水浴中加热至37°C。
2使用眼科剪刀剪碎组织,尽量剪碎
3.通过100µm的滤网过滤悬浮的组织块,并用PBS洗涤两次。将组织块转移到30 ml无菌容器中盖子密封严密。
注意:短而宽的罐子比高而窄的管子效果更好。或者,将纸巾片裹在50毫升无菌试管外,石蜡封口后平置。
4.加入所有消化溶液(总计4.5 ml),并将容器放置在37°C、转速设定为120 rpm的摇动水浴中的密封塑料袋中,或者,用石蜡膜密封容器,并将其放入设定为120rpm的加热轨道振荡器中。
5.15分钟后,取出并倒置离心管三次,然后再震荡15分钟。吸出胶原酶,补充有5-10mlFBS和1%P/S。
6.用10毫升血清学移液管轻轻吹打10到20次,直至组织絮状化后置于过滤悬架上依次通过100µm、70µm和最后40µm的细胞过滤器,以去除未消化的组织,获得单细胞悬浮液。
注意:不要在细胞滤网之间冲洗,以免酶消化过程中产生细胞碎屑。
7.将细胞悬浮液以200 x g离心4分钟,小心倾倒上清液,并将沉淀重新悬浮在1 ml红细胞裂解缓冲液中在室温下保持2分钟,然后用4毫升PBS稀释。
8.重复离心步骤,并将细胞重新悬浮在1mlPBS中。充分混合,取10µl细胞悬浮液进行细胞培养并计数。
9.将10µl细胞悬浮液与10µl台盼蓝染色剂混合,并将10µl混合物放在标准血细胞仪上进行细胞计数。
10.计算四个角落正方形(每个正方形细分为十六个小正方形)中明亮的圆形单元格的数量,除以4得到每个角平方的平均值。将平均值乘以2以说明染色稀释因子,然后每1ml样品乘以10^4便是获得细胞总数。
二. 细胞培养:
准备好培养瓶,初代建议使用T25瓶培养,为了获得更多的细胞 ,细胞铺板前建议使用细胞包被液给培养瓶进行包被,(启达生物:SD0044)培养箱包被15-20分钟后,使用PBS冲洗两次后待用
准备好周细胞专用培养基,此培养基包含周细胞生长因子和抑制成纤维和内皮细胞生长的小分子化合物 ,以促进周细胞生长更加纯化,培养瓶加入2ml左右的PGM周细胞培养基(启达生物:P4001),
细胞离心后用周细胞培养基重悬,初次铺板每个T25瓶不低于60万以上的细胞量进行铺板 ,48小时后换液 ,去除死细胞,
后期使用PGM培养基按照正常细胞操作换液或者传代即可。

脑周细胞48h的生长图
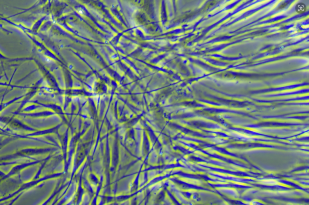
脑周细胞72h的生长图
并不是所有的周细胞都使用这个操作方法哦 ,针对不同的周细胞,可能有更加优化的提取方法,来看看下面各组织的使用的方法吧,
一、 脑
可以使用酶消化和外植体培养从白质和灰质中分离脑周细胞(92107120-122)。它们表达PDGFRβ、αSMA、CD13、NG2、CD146和结蛋白(121)。可在PGM培养基中保持15-20倍增。
二、 心
使用酶消化、过滤和免疫磁分离从心房和心室中分离心脏周细胞,以获得CD31–/CD34+细胞(21,32,55)。心脏周细胞可在PGM培养基中保持25倍增
三、骨骼肌
骨骼肌来源的周细胞主要通过外植体培养分离。不同的群体,如碱性磷酸酶/CD56–细胞和CD146+/NG2+/αSMA+/CD45–/CD31–/CD34–细胞,可以通过FACS或免疫磁性微珠纯化(77,78,93123124)。此周细胞极容易脱落 ,建议使用toprocult基质胶(启达生物:SD0058)稀释25倍包被,包被后使用PGM可达15倍以上扩增

四、骨髓
骨髓周细胞可以使用微珠细胞分选策略进行免疫磁性分离。骨髓样品用Ficoll Histopaque 1077处理以获得单核细胞。首先,从CD45+/CD34+级分中阴性纯化细胞群。然后,选择CD146+细胞并进一步扩增,通过流式细胞术和免疫细胞化学最终确认CD45–/CD34–/CD146+组合的纯度(105)。
五、肾
肾周细胞在调节通透性、肌成纤维细胞的形成、血管生成和肾髓质血流量方面至关重要(126-128)。在使用胶原酶混合物(IA、II和IV)进行组织消化后,对细胞进行FAC分选,以获得CD146+/CD34–/CD45–/CD56–周细胞群,其也表达经典的制造商PDGFRβ和NG2。传代时需使用细胞包被液(启达生物:SD0044)上进行培养扩增。
六、 肺
分离人肺周细胞的方法包括酶消化、磁性微球分选和FACS选择(109130-132)。然后,对细胞进行分选以收集CD45–/CD31–/CD326–/PDGFRβ+部分(109130)。此外,Kramann等人使用含有AY16(一种抗Trop2单克隆抗体)-DT3C缀合物的选择培养基分离肺周细胞,以消除上皮干细胞和内皮细胞(131)。经修饰的培养基筛选的细胞表达PDGFRβ和硫酸软骨素蛋白多糖4(CSPG4)。
七、皮肤
已经从新生儿包皮或成年女性乳房皮肤中分离出周细胞(133)。在用II型胶原酶或dispase消化后,通过FACS或免疫磁性微珠对VLA-1bri/CD45群体进行分类(112133135)。此外,皮肤周细胞表达人高分子量黑色素瘤相关抗原(HMW-MAA)、PDGFRβ、结蛋白、αSMA、α1β1-整合素、α-和γ-肌动蛋白亚型以及肌球蛋白(136)。

八、脐带
人脐带周细胞可以通过酶消化和外植体培养分离(31)。Helmbold等人使用CD146缀合的微珠对细胞进行免疫磁性分选,以分离CD146+群体(137)。Cathery等人通过外植体培养分离周细胞。对迁移的细胞进行免疫磁性分选,获得CD31/NG2+群体(31)。所有分离的群体均表现出CD34的特征性阴性表达,CD146和NG2的阳性表达。使用PGM周细胞培养基,细胞可达20倍增以上。
九、 视网膜
从色素层分离后,通过酶解分离人视网膜周细胞。将细胞接种在明胶预涂层的培养皿上,并与含有FBS的DMEM/F-12一起培养。通过NG2、αSMA、神经胶质原纤维酸性蛋白和细胞骨架结构蛋白的免疫荧光染色来鉴定视网膜周细胞的特征形态.
关注我们原代细胞提取不迷路
不用急,先把参考的文献步骤截个图
不用急,先把参考的文献步骤截个图
不用急,先把参考的文献步骤截个图
