AD的标志物就是β淀粉样蛋白( amyloid-β,Aβ) ,Aβ是由淀粉样前体蛋白( amyloid precursor protein,APP) 经 β-和 γ-分泌酶的蛋白水解作用而产生的含有 39~43 个氨基酸的多肽。人体内 Aβ最常见的亚型是 Aβ1-40 和 Aβ1- 42。它们会在大脑中聚集,使得大脑萎缩,功能退化。淀粉样蛋白对人的影响可能在确诊前20年就开始了,但是看不出任何异常。当患者出现认知功能障碍时,脑内已经出现了淀粉样斑块、神经纤维缠结、神经细胞数量减少的情况。

尽管对β淀粉样蛋白(或 Aβ假说)存在一定争议,但仍有证据表明,Aβ的产生和清除之间的不平衡是AD早期的起始因素。
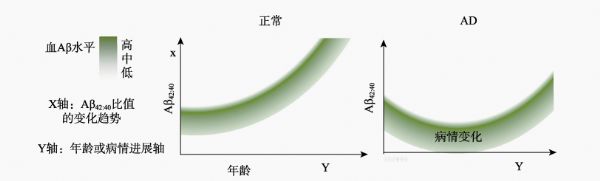
有研究认为,与 Aβ1-40 相比较,Aβ1- 42 更易于聚集,大脑中聚集的 Aβ纤维斑块是导致细胞死亡、记忆丧失和其他 AD 特征的神经毒素。脑脊液中最丰富的Aβ类型为Aβ1-40,其不易聚集,而 Aβ1- 42 则具有较高的聚集倾向,容易形成斑块。理论上,应检测脑中Aβ总量,再计算 Aβ1- 42在脑中Aβ总量中的比率,对了解斑块的形成具有参考意义。这一点科研界已达成共识,大部分研究倾向于测量脑脊液液中 Aβ42:40 的比值,可以得到一些相对一致的研究结果,即 AD 患者脑脊液的Aβ42:40比值会出现升高,与此同时血浆中Aβ42:40比值会下降。
为验证这个推论,2003年美国科学家Mayeux对 530 名老年人进行了流行病学调查,并采用夹心酶联免疫吸附测定法测定血浆中Aβ1- 42和 Aβ1-40水平,每隔 18 个月进行一次随访,其中307 名受试者在 3 年内重复检测血浆 Aβ1- 42和Aβ1-40 水平,结果表明,血浆 Aβ1- 42 和 Aβ1-40 水平随着年龄增加。2007年科学家Schupf 团队随访血浆 Aβ42 和 Aβ42:40 的比值基线水平较高人群,随着时间的推移,大约 4.5 年后,在可诊断为 AD 的个体中,其血浆 Aβ42 和 Aβ42:40 均较病前有所下降,与之前研究结果一致。由此可见在临床诊断中,需要用一个动态的指标观察个体 AD 发生发展情况,即将血浆 Aβ 基础水平与 Aβ42:40 比值结合起来,足够长时间内,连续监测三次以上,若观察到 Aβ42:40 的有一个趋势性的改变,再结合其他认知和心理检测结果便可对 AD做出预测性诊断,可为临床早发现早治疗提供依据。
2012年WHO关于阿尔茨海默病的报告中指出,AD已经成为了全球危机,每4秒钟就会新增1例痴呆病例,2013年估计全球4400万AD患者,到2030年将增加到7600万,到2050年将增加到1.35亿 。阿尔兹海默病的发病机理迄今尚不明确,至今也没有治疗阿尔茨海默症的特效药,已有的治疗手段仅能维持或减缓认知能力衰退的速度,而不能逆转已经恶化的痴呆,但有证据显示,约三分之一的痴呆是可以预防的,痴呆的早期诊断空前重要。此外,人工智能技术于AD 诊断、防治的结合也让人备受期待。
人类对疾病的认识和攻克从来都不是一帆风顺的,基于人类历史上天花、结核等一系列重大疾病的攻克,尤其近几年来肿瘤治疗领域的重大突破,让我们对早日清除大脑里的“橡皮擦”越来越有信心。
云克隆也一直在为AD研究助力,已向国内外用户提供AD相关研究的各类产品及实验服务。希望在不久的将来,能够收到科学界关于治疗AD的好消息!
云克隆AD部分相关产品