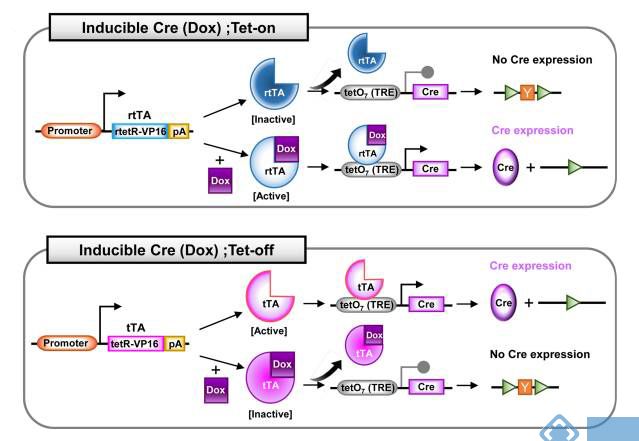
图5. 四环素诱导型tetO-Cre(Hyeonhui Kim, et al., Lab Anim Res. 2018)
枢密科技可提供Cre-loxP重组酶系统的载体构建服务及病毒包装服务。
参考文献:
1. 任荣荣, 王英伟. Cre/L oxp系统的应用及进展. 广州医学院学报. 2008; 36(2):78-80.
2. 孔维健, 常宇鑫, 昝春芳, 郑爽, 杨小玉. 基于Cre-loxP系统条件性基因敲除小鼠的构建及其应用进展. 中国实验诊断学. 2017; 21(12):2208-2211.
3. Kesha Rana, Rachel A Davey, Jeffrey D Zajac. Human androgen deficiency: insights gained from androgen receptor knockout mouse models. Asian J Androl. 2014; 16(2): 169–177.
4. Hyeonhui Kim, Minki Kim, Sun-Kyoung Im, Sungsoon Fang. Mouse Cre-LoxP system: general principles to determine tissue-specific roles of target genes. Lab Anim Res. 2018; 34(4): 147–159.
5. McLellan MA, Rosenthal NA, Pinto AR. Cre-loxP-Mediated Recombination: General Principles and Experimental Considerations. Curr Protoc Mouse Biol. 2017;7(1):1-12.
Cre-LoxP重组酶系统载体构建服务
Cre-LoxP系统
Cre-Loxp系统策略是进行基因组定点突变的新途径,可在DNA的特定位点上执行敲除、插入、激活、倒转及易位等。该系统在80年代被引入后,已被成功的应用于酵母菌、植物、哺乳动物细胞培养及小鼠身上。Cre-LoxP系统包括Cre重组酶和Loxp位点两个部分。
Cre重组酶是整合酶家族的一员,1981年从大肠杆菌噬菌体P1中发现,是最常用的位点特异性DNA重组酶。Cre基因有1029个碱基,Cre重组酶由343个氨基酸组成(约38kD),它不仅具有催化活性,而且跟限制酶相似,识别特异的DN A序列,如:loxP位点,引起重组。Cre重组酶有70% 的重组效率,不借助任何辅助因子,可作用于多种结构的DNA底物,如线形、环状甚至超螺旋DNA。
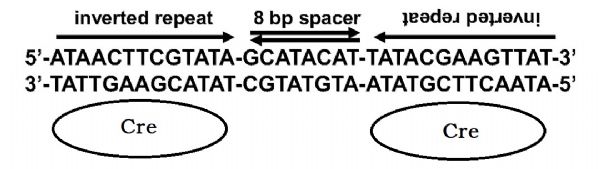
loxP位点是Cre重组酶作用的特异性重组位点,两个13 bp的反向重复序列和8 bp的间隔序列构成,长34 bp,具体序列如下:5’一ATAACTTCGTATA一GCATACAT一TATACGAAGTTAT一3’ / 3’一TATTGAAGCATAT 一CGTATGTA一ATATGCTTCAATA一5’。 两个反向重复序列是Cre的识别序列,中间的间隔序列是重组发生的位置,同时也决定了loxP位点的方向,根据loxP序列的排列方向产生不同的重组结果。
图1. Cre重组酶结合loxP的位点
Cre-loxP系统的原理
Cre-loxP系统存在以下几种诱导重组的方式,这是基于Cre重组酶与loxP位点的相互作用而实现的。当基因内存在loxP位点且有Cre重组酶存在时,Cre重组酶便会与loxP位点两端的反向重复序列区结合形成二聚体。此二聚体与其他loxP位点的二聚体结合,进而形成四聚体。随之,loxP位点之间的DNA序列被Cre重组酶切掉,切口通过DNA连接酶重新连接。DNA重组结果主要取决于loxP位点的方向及位置。
Cre重组酶介导的两个loxP序列间的特异性重组根据序列位置和方向的不同分为三种 情况:①当两个loxP序列位于同一条DNA链且方向相同时Cre重组酶能够敲除两个loxP序列间的DNA片段;②当两个loxP序列位于同一条DNA链且方向相反时,Cre重组酶能够反转两个loxP序列间的DNA片段;③当两个loxP序列位于不同DNA链上时,Cre重组酶能够介导loxP序列间DNA链的交换或染色体易位。Cre重组酶介导两个LoxP位点间的重组是一个动态、可逆的过程。
图2. Cre-loxP系统诱导重组的方式
Cre-loxP系统的优点
1. 高效性;
Cre重组酶与具有loxP位点的DNA片段形成复合物之后,可以快速引发DNA重组,不受靶基因大小和位置的影响。
2. 时空特异性;
可以特定时间实现体内特定种类器官或组织中的基因敲除,避免了某些基因完全敲除所导致的胚胎致死效应。
3. 应用范围广。
真核及原核均适用,不同组织、不同生理条件下均可起作用。
Cre-loxP系统的应用
一、条件性基因敲除小鼠的构建
1. 转基因动物依赖的基因敲除
一般应用Cre-loxP系统进行基因操作时较为常见的形式是两种转基因动物进行杂交。方法为:
(1) 利用原核注射的方法获得转基因“Cre小鼠”。在Cre基因上游加入特异性启动子,利用启动子控制Cre重组酶的表达;
(2) 在胚胎干细胞(ES)中通过置换型载体进行同源重组,向基因组靶位点引入选择标记基因,并在其两侧引入两个同向排列的Loxp位点。两条同源染色体都带有 Loxp位点且引入的Loxp位点不能干扰靶基因的转录。将该ES细胞打入假孕母鼠中,发育成“floxed小鼠”;
(3) “Cre小鼠”和“floxed小鼠”交配,Cre重组酶会在特定组织细胞表达,并切掉Loxp位点之间的靶基因和1个Loxp位点,从而达到靶基因的失活或敲除。
转基因动物的缺点:(1)实验周期长,成本高;
(2)区域特异性不高。
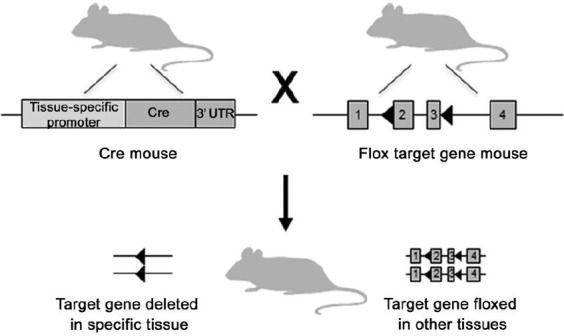
图3. 使用cre-loxp系统获得组织/细胞特异性基因敲除小鼠(Kesha Rana, et al., Asian J Androl, 2014)
1. 病毒依赖的基因敲除
由于转基因动物的诸多缺点,现如今越来越多的科研工作者选择新的方式来构建条件性基因敲除小鼠,即病毒依赖的Cre-loxP重组系统,方法为:
(1) 通过转基因动物办法获得“Cre小鼠”或“floxed小鼠”;
(2) 注射Cre病毒进loxP转基因小鼠体内,或者注射loxP病毒到Cre转基因小鼠体内,引入Cre或loxP元件。
病毒依赖的基因敲除的优点:(1)实验周期短,成本小;
(2)区域特异性高。
二、基因插入
采用同源重组技术,在基因组上人工构建两个Loxp 位点,借助构建的两个Loxp 位点,把两端带有Loxp 位点的外源基因重组到基因组上,此种重组是双向的,既可以把外源基因重组到小鼠基因组内,也可把小鼠基因组内源基因重组出来,这是定点整合的重要手段之一。
三、基因激活
利用Cre/Loxp系统不仅可对基因进行敲除,还可对基因进行特定激活,了解基因的正向效应。在两个同向Loxp位点之间加入终止信号,Loxp位点后加入靶基因,与Cre小鼠交配后,Cre重组酶切除终止信号及1个Loxp位点,其Loxp位点后面的靶基因便被“激活”表达。
四、基因倒转、易位等
Cre-loxP系统的新进展
1. 对Cre元件的改造:在Cre元件的C端接上雌激素受体(ER)的配体结合结构域,为了避免体内雌激素的干扰,可对雌激素受体的配体结合区做一定程度的改变,使其只能和某些雌激素衍生物相结合。目前使用最多的是Cre-ERT2突变体,融合蛋白Cre-ERT2不能入核,定位在胞浆内,当雌激素衍生物tamoxifen结合到Cre-ERT2受体结合结构域后,蛋白才会通过构象变化从锚定蛋白HSP90上解离下来,进入细胞核,识别loxP位点并发生重组。通过控制tamoxifen的注射时间,就可以调控基因重组的时间特异性。
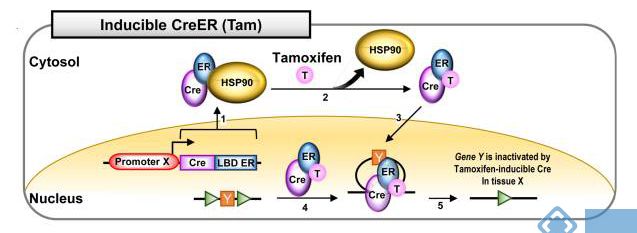
图4. 他莫昔芬诱导的Cre-ER系统(Hyeonhui Kim, et al., Lab Anim Res. 2018)
1. 对loxP元件的改造:loxP元件也可以在间隔区和回文序列进行突变,不同的碱基选择就造就了不同的lox位点,常见的有 lox2272、lox511、lox5171、loxN和loxP等。突变后的loxP序列和同样突变的loxP序列匹配,才能被Cre重组酶识别和重组,而不能和未突变的loxP序列匹配,这样就可以将不同的loxP序列组合用于控制多个基因,在Cre重组酶的作用下,实现多个基因的重组。Brainbow技术就是根据loxP序列的改造而实现的。
2. 四环素诱导型tetO-Cre:将四环素调控系统与Cre-loxP系统相结合,需要用两种转基因小鼠交配使用。一种是由四环素响应启动子元件(TRE, 也叫 tetO)控制的Cre工具鼠(TRE-Cre, 也叫tetO-Cre);另一种是由组织特异性启动子驱动的表达四环