荧光定量PCR实验因为灵敏度高所以经常是差之毫厘谬以千里,所以在实验过程中,我们需要注意诸多细节,谨慎操作。小伙伴们看到这里就要着急了,我怎样才能做好qPCR实验,拿到实验结果,发表高分文章,走上人生巅峰呢?

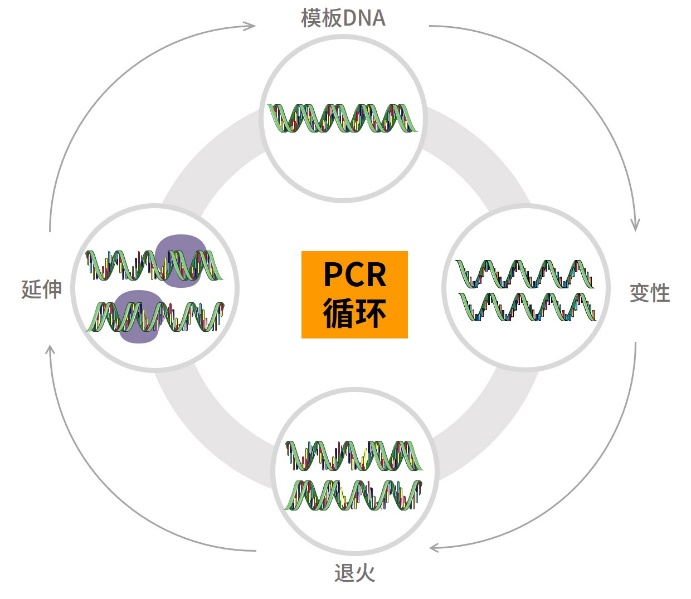
图.PCR循环流程
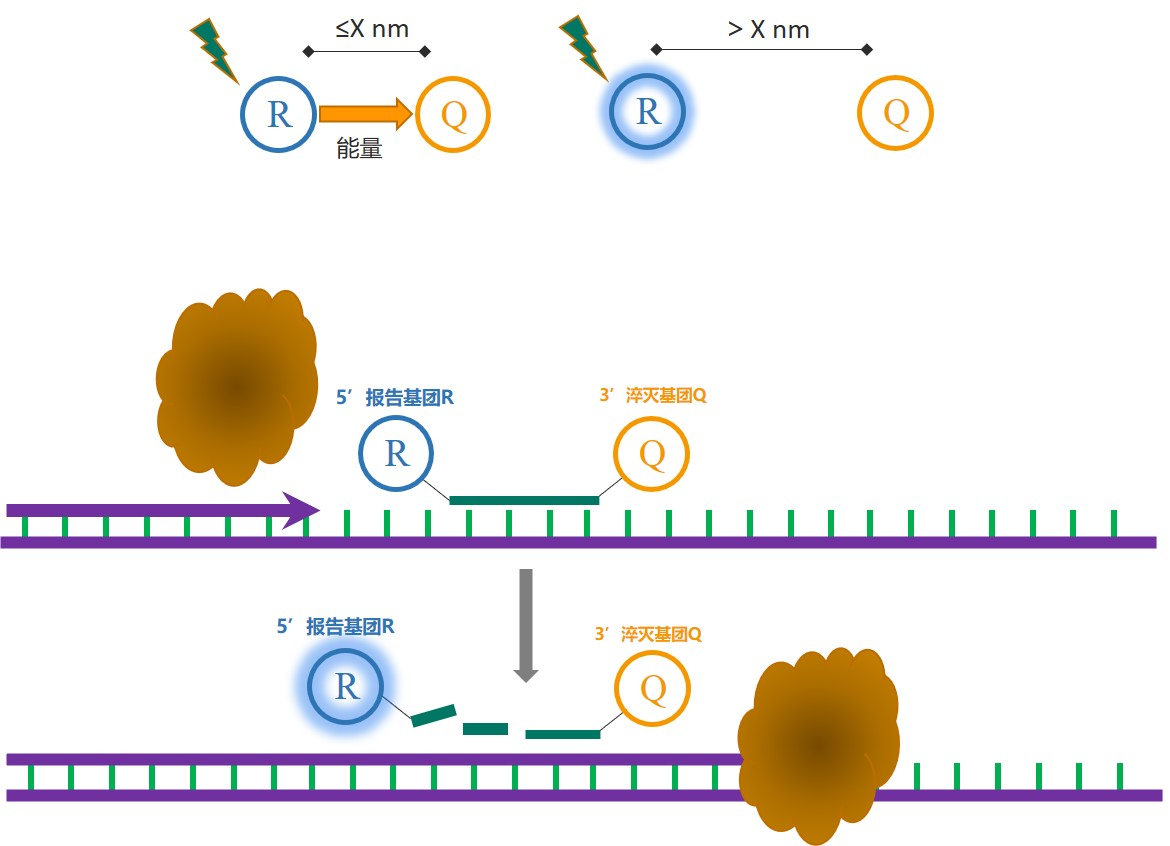
|
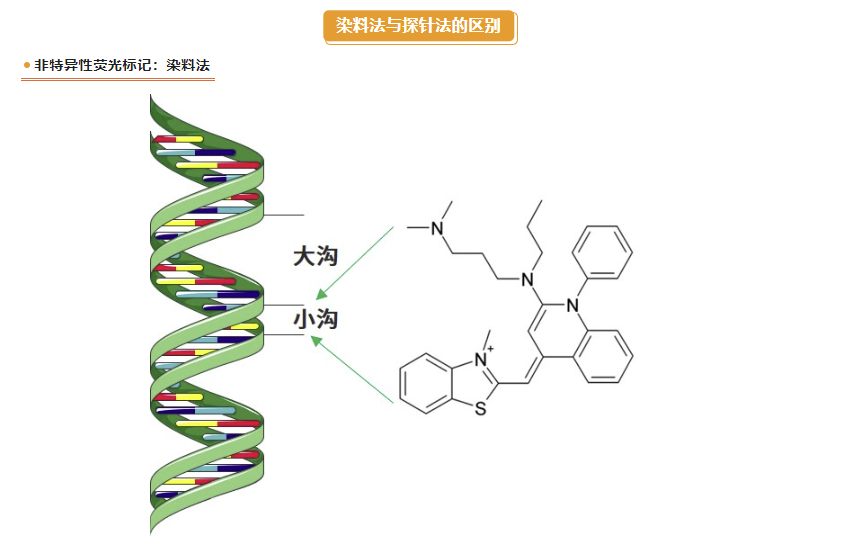
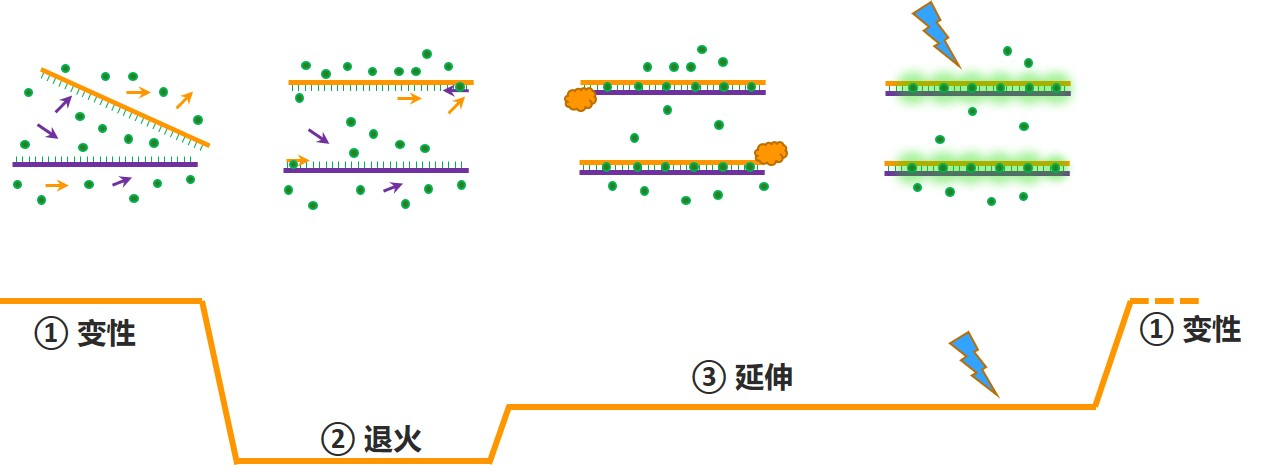
染料法荧光定量PCR |
探针法荧光定量PCR |
|
|
特异性 |
中 |
高 |
|
灵敏度 |
中 |
高 |
|
可重复性 |
中 |
高 |
|
多重反应 |
- |
可多重 |
|
探针/引物设计 |
引物 |
探针+引物 |
|
实验成本 |
低 |
高 |
|
应用 |
特定基因表达差异分析;DNA定量 |
特定基因表达分析;DNA定量;SNPs基因分析;基因突变检测;产前遗传病检测;传染病早期病原体检测 |
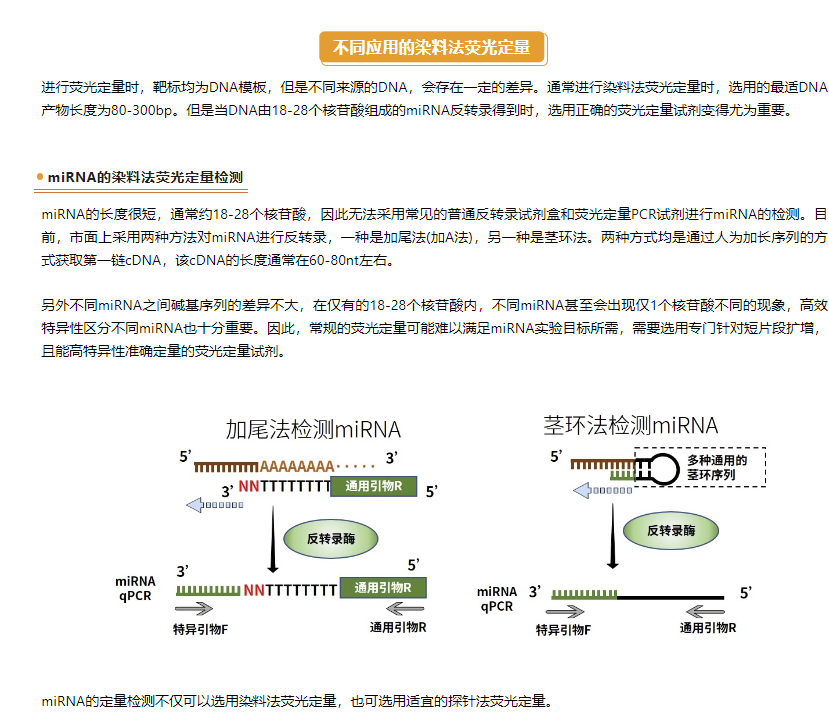
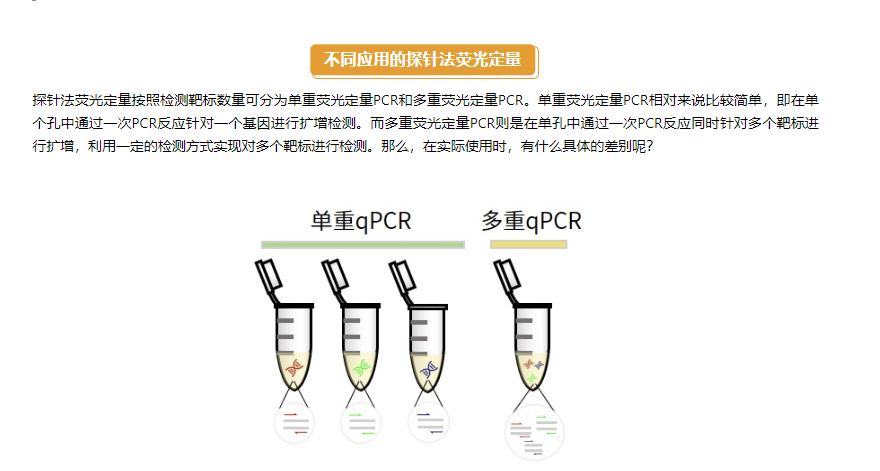
多重荧光检测,可以通过单个PCR反应中进行多个基因的扩增从而减少qPCR反应所需要的样品量,且该方式和单重荧光定量检测一样灵敏准确。除了节省样本量外,还可节省试剂以及设置实验程序和分析实验结果所需要的时间。单孔扩增多个基因也可最大限度地减少移液误差。
使用多重荧光定量PCR也有需要注意的事项,其中最为重要的是,需要保证不同基因在单重荧光定量反应中和多重荧光定量反应中的结果是一致的。尤其是扩增的基因中同时存在着低丰度表达基因和高丰度表达基因。

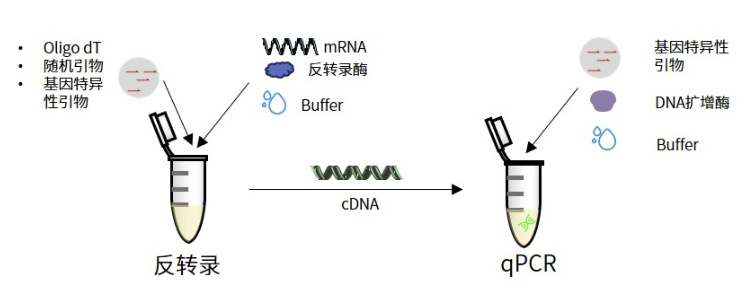
-
cDNA量充足:反转录后产生的cDNA可选择通过稀释或者直接使用的方式满足多次实时荧光定量实验;
-
满足多靶标:通过oligo dT和随机引物,可以从单个RNA样本中扩增多个靶标。
-
便捷性差:两步反应需要更多的处理,不太适合高通量应用;
-
污染风险:由于每个步骤都需要使用单独的管子,污染的风险增加;
-
cDNA产物中残留试剂的抑制:反转录酶和反转录缓冲液残留会一定程度抑制荧光定量PCR,因此在荧光定量PCR中建议仅使用10%的cDNA进行反应。若稀释不当,相关残留组分可能会抑制DNA聚合酶。
-
减少污染:一管一步式可防止在反转录和荧光定量PCR阶段之间引入污染物;
-
便捷:移液步骤减少,手动操作时间减少;
-
高通量检测:每个样本获得结果的总时间缩短且可重现性高;
-
灵敏度高:所有产生的第一链cDNA都可用于实时PCR扩增,一定程度上提高灵敏度。
-
二聚体风险增加:上下游基因特异性引物在42℃-50℃下更易发生二聚体聚合,从而导致非特异扩增;
-
检测靶标数少:单一RNA模板能够检测的靶标数量相对较少。