生物医药行业的快速发展,越来越多的生物制品开始服务于人类健康,治疗性抗体药物、细胞治疗、病毒载体疫苗等需求日益庞大。不同于传统口服类药物,大量生物制品通过注射等给药方式直接进入体内,因此更需要严格的质量监管来保证生物制品的安全性和有效性。宿主核酸的残留因其可能带来的传染性或者致瘤的风险而被作为生物制品安全监管中的重要一项。WHO及世界各国对宿主核酸的残留都有严格的规定,如疫苗及治疗类生物制品的DNA残留量通常控制在100pg/剂量以下,部分产品甚至要求DNA残留量不高于10pg/剂量。因此,解决宿主核酸的残留是生物制品生产过程中必须面对的问题。
全能核酸酶是一种来源于SerratiaMarcescen的基因工程酶,它可以降解所有形式的DNA和RNA,包括单链、双链、线状、环状、天然以及变性的核酸,将它们消化成3-8个碱基长度的5’-单磷酸寡核苷酸,且不具有碱基识别特异性。因此,在一些药物的生产工艺中常使用全能核酸酶去除残留核酸,如能有效去除疫苗样品、细胞和基因治疗病毒样品及重组蛋白药物中的核酸污染,降低核酸残留毒性风险,提高产品安全性;另外,在蛋白分析样品制备、改善重组蛋白纯化工艺、提高蛋白产量、细胞冻存等方面也可通过使用全能核酸酶处理核酸来达到理想实验效果。
为支持生物制品开发,ACROBiosystems百普赛斯依托GMP级别质量体系平台,成功开发了GMP级别GENIUS™ Nuclease全能核酸酶,具有纯度高、酶活高(>1.2E+06 unit/mg)、反应条件更广泛等产品特性,且已完成FDA DMF备案。GMP GENIUS™ Nuclease可高效去除残留核酸,适用于细胞治疗、基因治疗、疫苗及其他生物制品的研究和生产。
| 货号 | GMP-NUES19 |
| 商品名称 | GMP GENIUS™Nuclease DMF Filed |
GMP级别全能核酸酶活动来袭
2023年6月1日-2023年6月30日
「GMP级别全能核酸酶——GENIUS™ Nuclease」
买多少送多少!
✍ GMP GENIUS™ Nuclease 纯度>99%
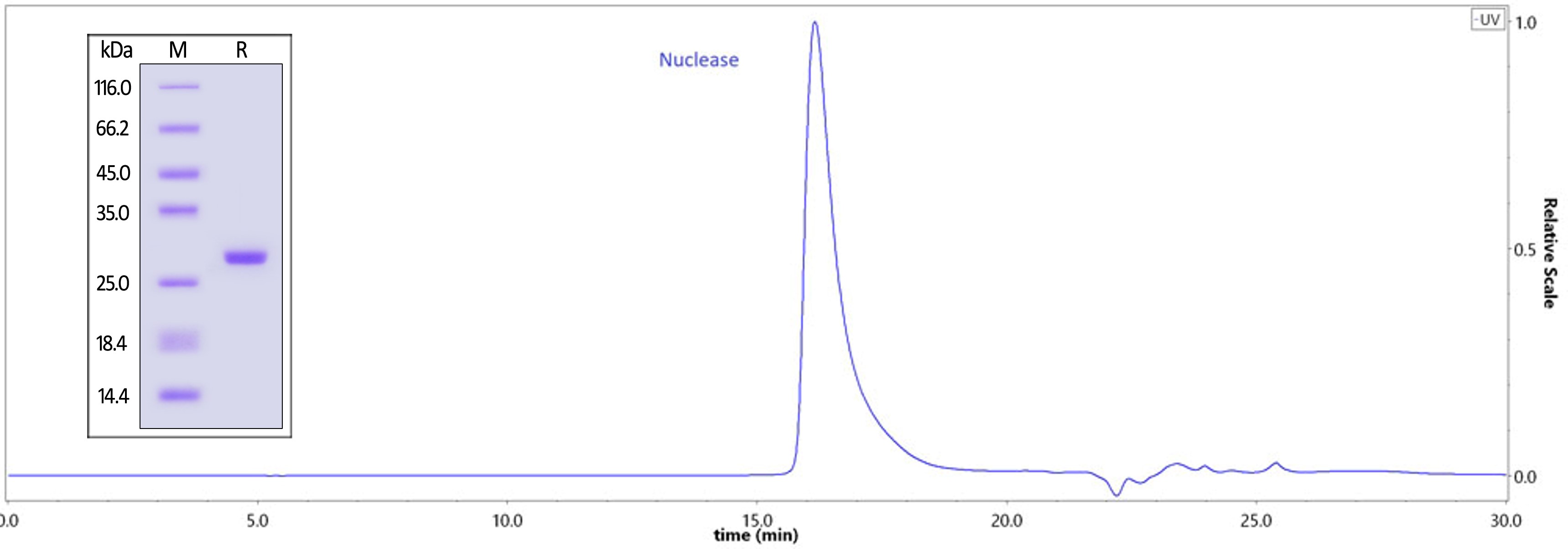
The purity of GMP GENIUSNuclease (Cat. No. GMP-NUES19) was greater than 99% as determined by SEC-HPLC.
✍ 阳离子对GMP GENIUS™ Nuclease酶活的影响
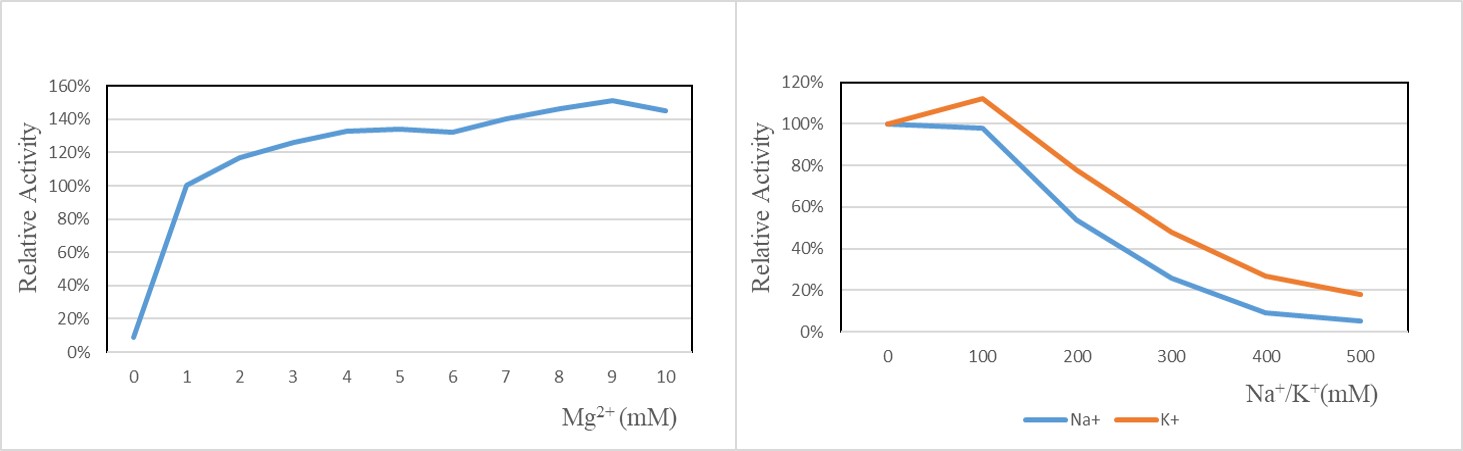
Mg2+对GENIUS™ Nuclease发挥酶活必需的,浓度至少≥1mM;100mM的Na+或K+对酶活无明显抑制作用,浓度大于500mM时,酶活基本丧失;
✍ 反应温度和PH值对GMP GENIUS™ Nuclease酶活的影响
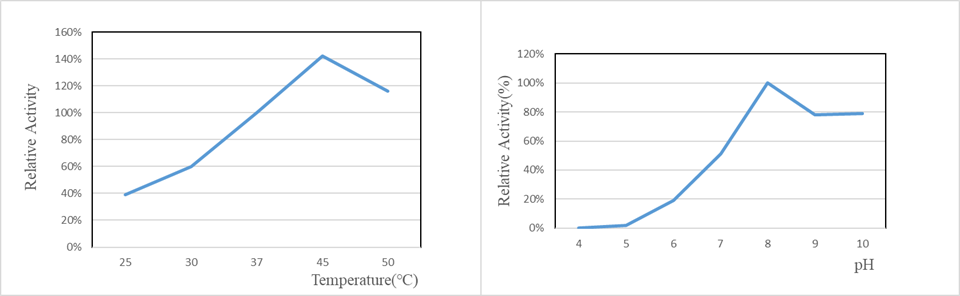
有效酶反应温度区间0-50℃;pH 为8时酶活最高,pH ≤5时酶几乎完全失活。
✍ 常用缓冲液对GMP GENIUS™ Nuclease酶活的影响
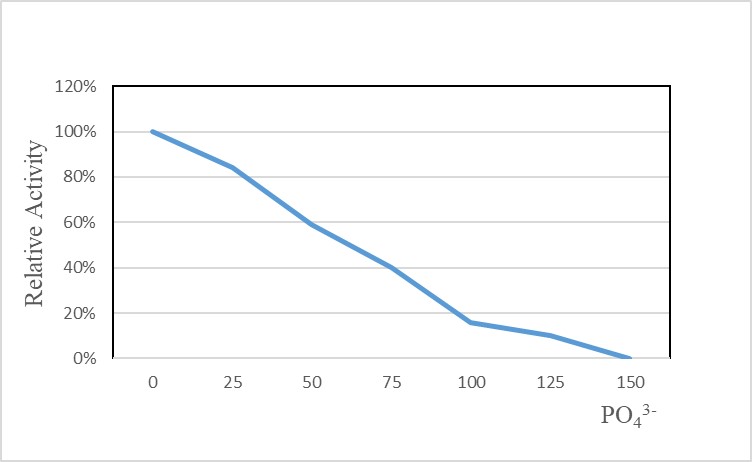
PO43-对酶活有明显抑制作用,125mM PO43-使酶几乎完全失活;
✍ 变性剂对GMP GENIUS™ Nuclease酶活的影响
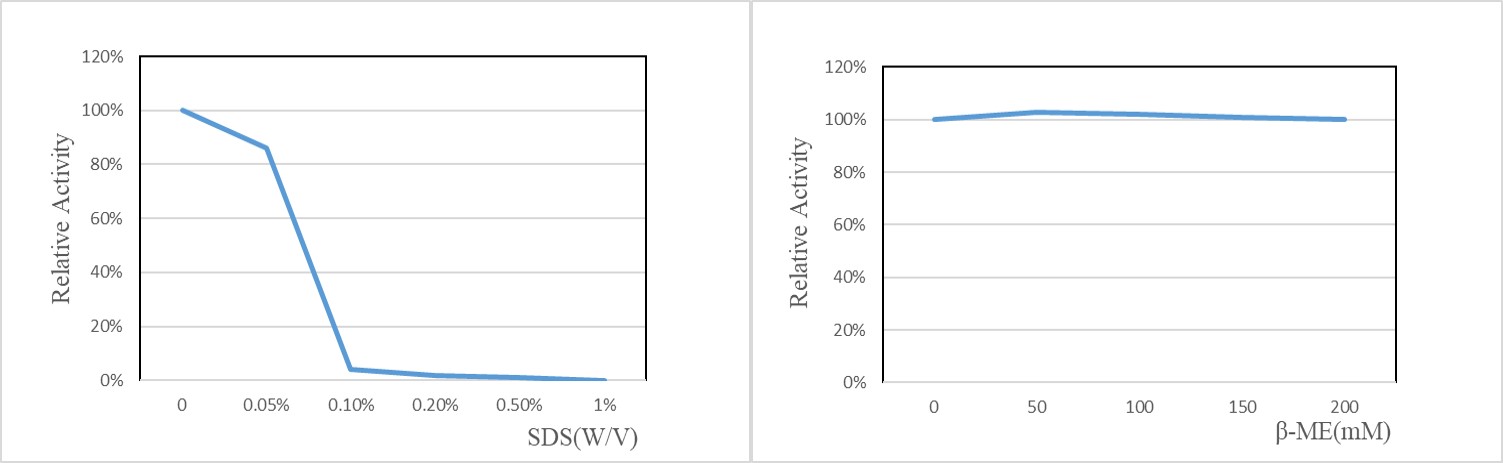
SDS对酶活有明显抑制作用,0.1%SDS使几乎酶完全失活;200mM内β-巯基乙醇对酶活无抑制作用。
✍ 蛋白变性剂硫酸铵和表面活性剂Tween20对GMP GENIUS™ Nuclease酶活的影响
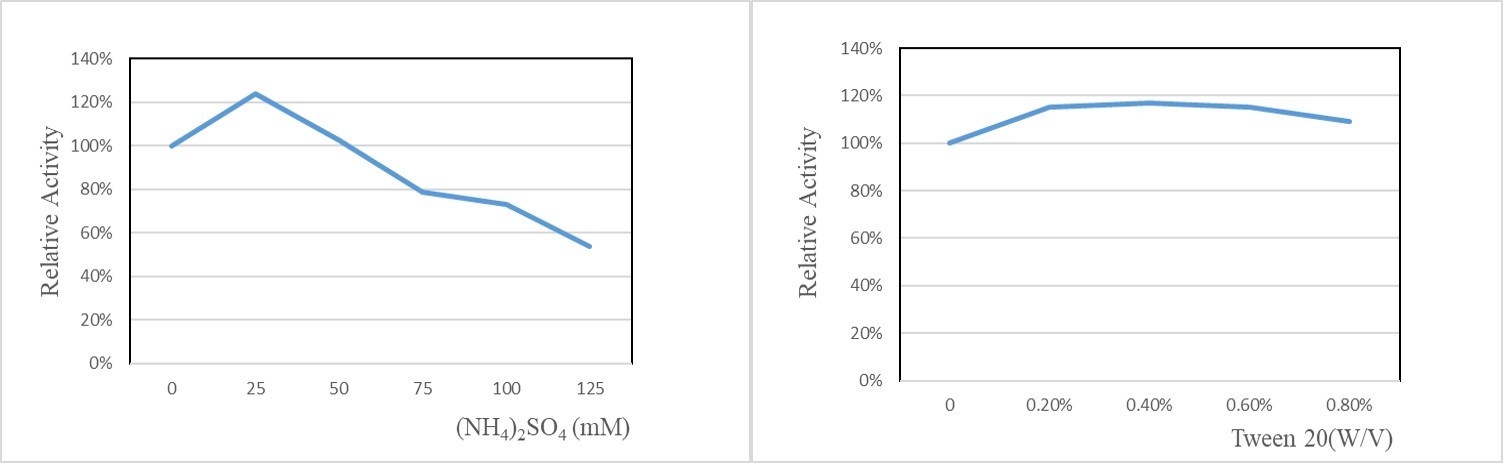
(NH4)2SO4浓度≤50mM对酶活无抑制作用,≥75mM时会抑制酶活;Tween 20浓度≤ 0.8%对酶活无抑制作用。
✍ GMP GENIUS™ Nuclease稳定性测试
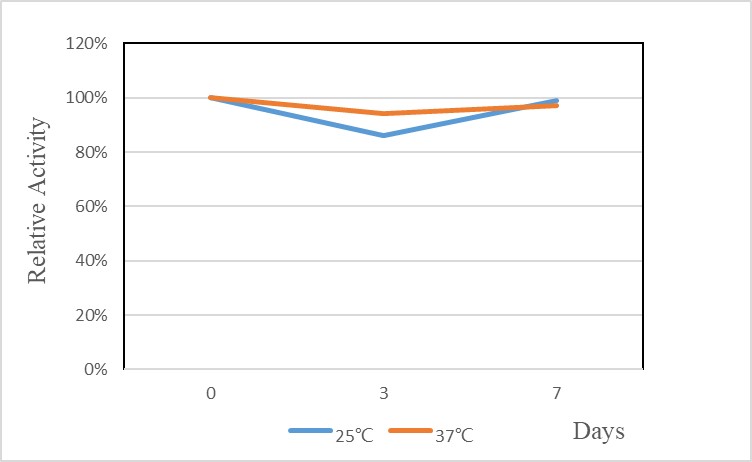
GMP GENIUS™ Nuclease在25℃/37℃放置7天,性能无影响。
在通过核酸酶处理生物制品的过程中,可能会引入微量核酸酶残留,由于全能核酸酶本身也属于外源性物质,这些微量残留会对后续生物制品的应用造成一定的影响,并可能会引起毒性或免疫反应。因此,对核酸酶残留进行精确检测是保证相关生物制品活性及安全性的重要条件。在生物制品中的安全性监管中,全能核酸酶的残留量也是衡量生物制品质量的重要指标之一。
ACROBiosystems 百普赛斯可提供具有高灵敏、高特异的全能核酸酶残留检测试剂盒,GENIUS™Nuclease ELISA Kit(货号:CRS-A016),解决您的全能核酸酶残留问题。
★ 灵敏度高达2.733pg/mL,能够准确定量培养基上清中核酸酶的微量残留;
★ 适配性强,除ACRO自产全能核酸酶外,还可兼容市面多家酶产品;
★ 产品性能稳定,批内及批间精密度<10%;
★ 可免费提供完整方法学验证报告;
★ 原料自产,产量高、货期短、供货稳定。
更多推荐产品

ACROBiosystems
inquiry@acrobiosystems.com
15117918562
(备注:姓名+公司)




