乳腺癌(Breast cancer,BC)被称为红颜杀手,是女性健康的一大威胁。在2020年,乳腺癌取代肺癌,已成为全球第一大癌症。在我国,乳腺癌的发病率也在逐年提升,大中城市女性乳腺癌发病率比其他中小城市和农村地区高出2-3倍,发病呈年轻化、双峰趋势。
三阴性乳腺癌(Triple-negative breast cancer,TNBC)是以雌激素受体(ER)、孕激素受体(PR)和人表皮生长因子受体(HER2)阴性表达为特征的乳腺癌,占所有乳腺癌的10-20%。TNBC被认为是一种高度异质性疾病,其内脏转移发生率高,缺乏公认的治疗靶点,临床治疗是一个巨大的挑战。虽然化疗已被证明可以改善临床结果,但复发率仍然很高,而且在治疗过程中往往会产生化疗耐药性。对TNBC进行深入的分子表征是揭示这些表型潜在机制不可替代的方法,并为探索该病的治疗靶点提供了坚实的基础。
2022年2月1日,复旦大学附属肿瘤医院乳腺外科邵志敏教授、江一舟教授领衔团队在 Cell Research(IF=25.617)杂志上发表了题为“Comprehensive metabolomics expands precision medicine for triple-negative breast cancer”的研究成果,分析了330例TNBC样本和149对正常乳腺组织中的极性代谢组和脂质组,构建了一个大型TNBC代谢组学图谱,将TNBC分为3个代谢亚型。
2022年3月1日,国家蛋白质科学中心秦钧教授、复旦大学附属肿瘤医院乳腺外科邵志敏教授、国家蛋白质科学中心朱伟民教授领衔团队在Cell Reports(IF=9.423)杂志上发表题为“Proteome-centric cross-omics characterization and integrated network analyses of triple-negative breast cancer”的研究成果,报告了一项对90例TNBC配对样本在定量、磷酸化和DNA结合能力方面的全面蛋白质组学研究,将其分为4个亚型(iP-1-4),每个亚型具有不同的分子和通路特征以及临床结果。


在第一篇报道中,结合转录组学和基因组学数据,研究人员从代谢组学层面将TNBC分为三个不同的代谢亚组:C1,以神经酰胺和脂肪酸的富集为特征;C2,具有与氧化反应和糖基转移相关的代谢产物的上调;而C3则是代谢失调程度最低的。
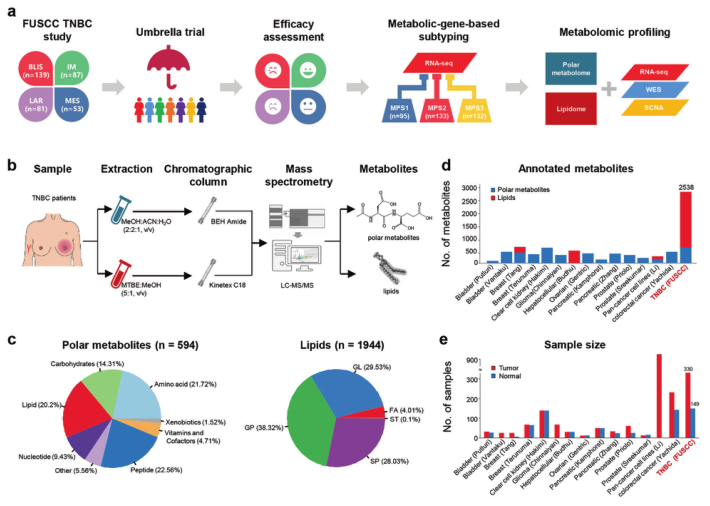
图1 TNBC中极性代谢组和脂质组检测概述
基于这个新开发的代谢组学数据集,研究人员进一步改进了以前的TNBC转录组亚型,并确定了一些关键的亚型特异性代谢产物作为潜在的治疗靶点。转录组学腔面雄激素受体(LAR)亚型与代谢组学C1亚型重叠。在患者来源的类器官和异种移植模型上的实验表明,靶向神经酰胺途径的中间产物鞘氨醇-1-磷酸(S1P)是治疗LAR肿瘤的一种有前途的方法。此外,转录组基底样免疫抑制(BLIS)亚型包含两个预后代谢亚组(C2和C3),可以通过机器学习方法进行区分。研究人员发现N-乙酰天冬氨酰谷氨酸(NAAG)是一种重要的促肿瘤代谢产物,也是高危BLIS肿瘤的潜在治疗靶点。该研究揭示了TNBC代谢组学的临床意义,它不仅可以优化转录组亚型系统,还可以提出新的治疗靶点。该代谢组学数据集可作为一个有用的公共资源来促进TNBC精准治疗。
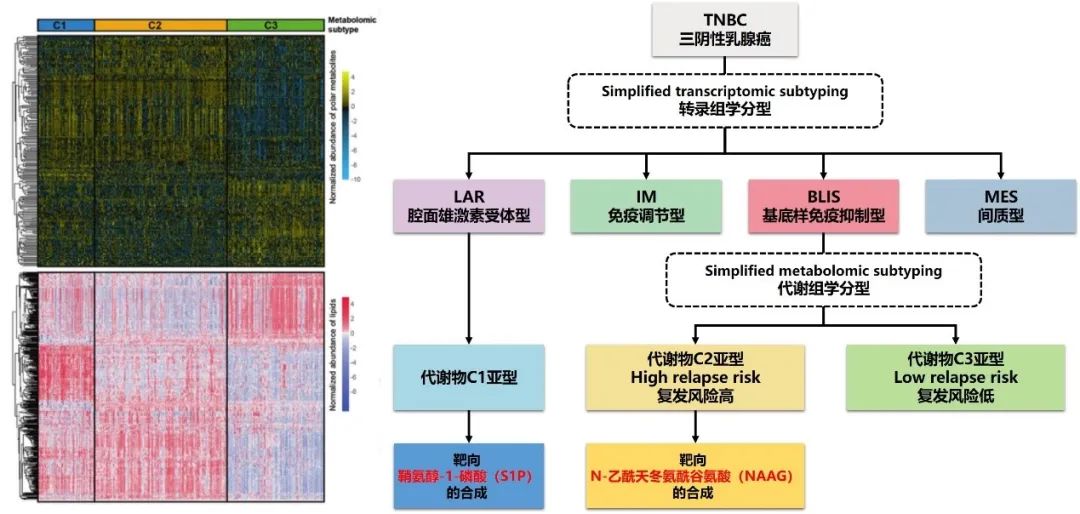
图2 TNBC的转录组学和代谢组学亚型系统的整合,用于潜在的临床应用
临床蛋白质组肿瘤分析联合会(CPTAC)对乳腺癌的研究表明,尽管CNA(拷贝数变异)对mRNA丰度变化表现出强烈的顺式和反式作用,但只有一小部分变化可以在蛋白质水平上反映出来。因此,通过蛋白质组检测可获得研究样本的全景蛋白质快照,进一步集成和网络分析,将为我们提供不同蛋白质方面及其丰富关系的系统视图。
图3 以蛋白质组学为中心的TNBC跨组学特征和整合网络分析
在第二篇报道中,研究人员从之前描述的FUSCCTNBC队列中收集了90名患者的肿瘤和配对非癌邻近组织(NAT)样本。对样本进行Label-free蛋白质组学分析:89个肿瘤和71个NAT进行全蛋白质组分析,88个肿瘤和72个NAT进行磷酸化蛋白质组分析,通过转录因子串联结合元件序列(catTFRE)从78个肿瘤和60对NAT样本中收集的DNA结合蛋白(DBPs)进行质谱分析。排除不符合标准的样本后,从82个肿瘤和66个配对NAT的全局蛋白质组分析中获得了7531个蛋白质,从86个肿瘤和70个配对NAT的磷酸蛋白质组分析中获得了4194个蛋白质上的20069个磷酸位点,而catTFRE分析从74个肿瘤和57个配对NAT中获得了2967个DBPs。
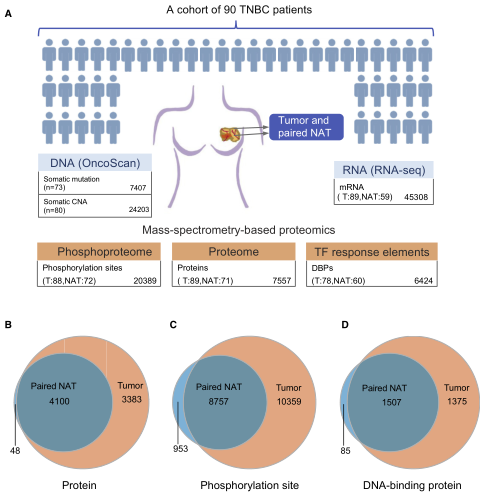
图4 TNBC的多组学数据概述
主成分(PCA)分析表明,肿瘤和NAT之间存在明显差异的蛋白质组图谱,肿瘤的异质性程度高于NAT。使用iClusterPlus进行综合聚类分析将肿瘤样本被分为四个亚型(表示为iP-1-4),这些亚型在预后上表现出显著差异,每个亚型都表现出不同的分子和通路特征。iP-1亚型表现出强烈的增殖特征。iP-2亚型的不良预后与其特征性脂质代谢途径密切相关,尤其是脂肪酸合成途径。iP-3亚型的特点是免疫过程高度富集。在iP-4亚型中,上皮间充质通路中与肿瘤转移相关的分子聚集在一起。
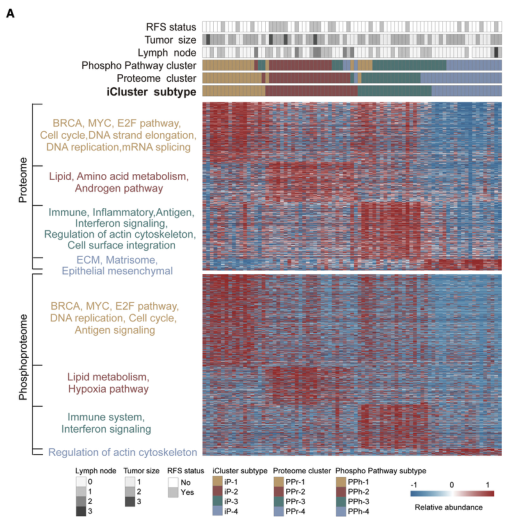
图5 整合蛋白质组亚型
利用这些蛋白质组学数据集以及同一队列的基因组和转录组学数据进行联合分析,描绘上游调节器和下游过程之间的调节网络。作者发现NAE1是iP-1亚型的潜在药物靶点,AKT1/FASN等一系列脂肪酸代谢的关键分子是iP-2亚型的潜在靶点。TNBC的蛋白质、通路和网络库为进一步临床探索和深入研究疾病的分子机制提供了有价值的理论基础。
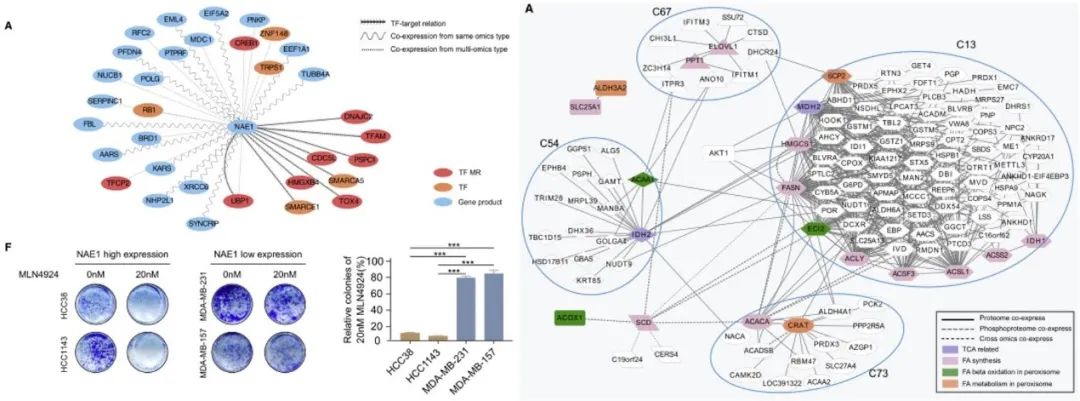
图6 iP-1和iP-2的潜在药物靶点
通过利用跨组学数据类型和综合分析方法,研究人员构建了一个有价值的TNBC分子数据图谱,包括亚型特异性蛋白质、通路和通过组装和共表达分析构建的分子网络。这一发现为进一步的TNBC研究奠定了坚实的基础,不仅用于描述复杂的分子机制,从而对与疾病发生和进展相关的代谢过程提供系统的见解,还用于探索更容易转化为有效药物的靶点或鸡尾酒疗法。
小编小结
组学技术的进步带来了TNBC的多重分型,但在临床应用上仍然具有挑战性。其潜在问题在于整合来自不同方法和来源的数据集,也需要一种快速且经济高效的肿瘤分类方法。上述研究为开发适合每个TNBC患者靶向治疗的精准医学增添了新的亮点。
中科优品推荐
【中科新生命】可以整合基因组学、转录组学、蛋白质组学、磷酸化蛋白质组学、代谢组学等多组学技术,揭示新的肿瘤代谢脆弱性,为难治性肿瘤亚型的精准医学开拓道路。