01
什么是树突状细胞(DC)?
DC细胞是“Dendritic Cell”,中文名称是树突状细胞。树突状细胞是人体内最有效的抗原递呈细胞(antigen presenting cell, APC)。DC细胞是唯一能够显著刺激初始T细胞增值的APC,其他种类的APC(如单核巨噬细胞,B细胞等)仅能刺激已活化的或者记忆性的T细胞,因此DC细胞是适应性T细胞免疫应答的始动者,在肿瘤免疫中发挥着及其重要的作用。DC 表面高表达MHC -I和MHC -II类分子,具有特异性表面标志的细胞。其对抗原摄取,加工以及刺激T细胞使其激活,并最终决定T细胞的分化方向。
02
DC的来源
DC细胞在体内含量甚微, 从体内直接分离出DC耗时而且细胞产量很低,这极大地限制了DC的研究和应用。但DC能从不同组织里的DC前体细胞分化、诱导而来, 如骨髓液的前体细胞,外周血和脐带血的单核细胞。
对于人,由于人外周血的取材最为方便且单核细胞数量最多,所以最常用的方法是从人外周血单个核细胞(PBMC)诱导DC。而对于小鼠,最常见的方法是从骨髓细胞诱导产生DC,即骨髓来源的DC(Bone Marrow-Derived Dendritic Cells,BMDC)。
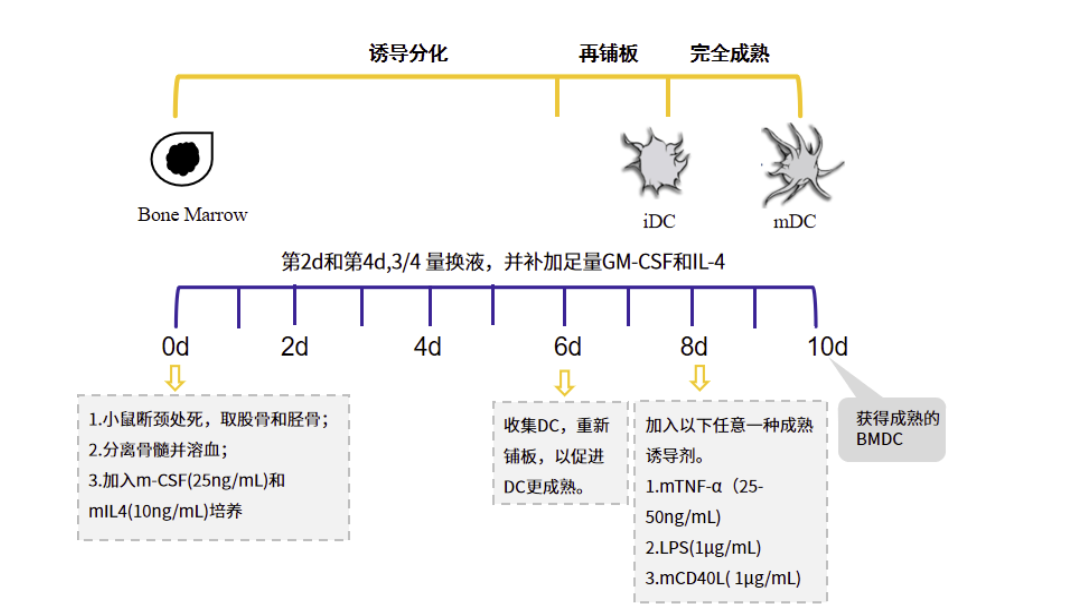
图1.经典的 BMDC 制备方法简图
03
BMDC制备方法
常见的小鼠BMDC制备方法有:
01 经典的BMDC培养法-Inaba法(改良);02 BMDC的大量制备法-Sons法;03
BMDC的大量制备法—Lutz法。
经典的BMDC培养法-Inaba法(改良)
背景
1. Inaba法获得的BMDC 数目为5-7 x 106个/小鼠;
2. Inaba原法仅用GM-CSF来诱导BMDC的产生,虽然得到的BMDC在混合淋巴细胞反应中有较强的刺激能力,但DC的成熟度不及GM-CSF+IL-4的联合诱导,所以后来的改良法中多用GM-CSF+IL-4联合诱导。
培养步骤
1. 小鼠骨髓细胞的获得
1.1 小鼠(6-10周龄)颈椎脱臼法处死,手术取出所有股骨和胫骨,并剪刀和镊子将骨周围的肌肉组织尽量去除干净;【注】:不要损伤到骨。
1.2 将骨移至超净台内,并用盛有70%酒精的无菌培养皿浸泡2-5min,以消毒灭菌,然后用无菌的PBS洗2次;
1.3 将骨移入另一个盛有PBS 的新培养皿中,用剪刀剪去骨两端,再用注射器抽取PBS,针头分别从骨两端插入骨髓腔,反复冲洗出骨髓至培养皿中,直至骨完全变白;
1.4 收集骨髓悬液,用200目尼龙网滤去小碎片和肌肉组织;
1.5 过滤液1200rpm 离心5min,弃上清;
1.6 加入2 ml氯化铵红细胞裂解液(1x),重悬细胞,室温孵育3-5min,最长10min;
1.7 加入10 ml PBS 中和裂解液的作用,然后1200 rpm 离心5min,弃上清;
1.8 PBS 洗1 次,然后用含10% FBS的RPMI1640培养液重悬细胞,至此已获得小鼠骨髓细胞。
·
氯化铵红细胞裂解液的配制:
·
1)先配制10x的贮存液,配法如下:称取82.9g NH4Cl,10.0gKHCO3和0.37g Na2EDTA,溶于1L的蒸馏水中,0.22μm滤膜过滤除菌,4℃储存6个月;
·
2)临用前,将10x贮存液用无菌蒸馏水1 : 9稀释成1x工作液即可。
·
【注】:因氯化铵红细胞裂解液对骨髓细胞有一定的伤害作用,所以要尽量缩短溶血时间。
·
2. BMDC 的诱导分化
2.1 步骤1中获得的小鼠骨髓细胞计数后用含10% FBS的RPMI 1640完全培养液调整细胞浓度为0.5-1x 106/ml;
2.2 铺至24 孔培养板内,每孔1ml 细胞,同时加入重组小鼠GM-CSF (20ng/ml)和IL-4 (10ng/ml),37℃,5% CO2培养箱培养,此为培养的第0天;
·
【注】:
·
1) 一般一只小鼠大约可收获4-5x107个骨髓细胞,所以可以铺至少40-50个24 孔板板孔。
2)GM-CSF 和IL-4 的使用浓度区间分别为20-50ng/ml 和10-40ng/ml。
·
2.3 每2天轻轻摇晃培养板,然后3/4 体积更换新鲜培养液,并补足细胞因子。
2.4 在第5天和第8天之间,轻柔吹打培养液,收集悬浮细胞及疏松贴壁生长的细胞;
2.5 1200rpm离心5min,弃上清;
2.6 用含10% FBS的RPMI 1640完全培养液重悬细胞并计数,然后调整细胞浓度至1×106/ml,并加入重组小鼠GM-CSF (20 ng/ml)和IL-4 (10ng/ml);
2.7 细胞铺板至100mm培养皿(每皿最多10ml)或6孔培养板(2m/孔)。
2.8 37℃,5% CO2培养箱继续培养1-2天;
2.9 收集悬浮细胞,即为较成熟的BMDC。
·
【注】:
·
1)第2.5-2.8步为再铺板步骤,目的是使第2.4步获得的BMDC更加成熟。
2)再铺板后的3h内可见许多棘状贴壁细胞从DC簇中迁移出来,而培养1天后会发现这些贴壁细胞从培养板底脱离,而且可以看见在培养液中漂浮着许多典型的DC。
·
3. BMDC的完全成熟
·
【注】:
·
步骤2中获得的BMDC并非完全成熟的DC,若想得到完全成熟的DC,还需LPS,CD40L 或TNF-a 等的诱导。
·
3.1 步骤2.4 或2.9 中获得的BMDC以1200rpm离心5min,弃上清;
3.2 用含重组小鼠GM-CSF (20 ng/ml)和IL-4 (10ng/ml)的RPMI完全培养液重悬沉淀,计数后调整细胞浓度为1×106/ml;
3.3 加入24 孔培养板中,并加入成熟诱导剂,如TNF-α (250U/ml),LPS (1μg/ml)、或CD40L(1μg/ml)等;
3.4 37℃,5% CO2 培养箱培养2天;
3.5 收集悬浮细胞及疏松贴壁生长的细胞即为成熟树突状细胞。
BMDC大量制备法-Son 法
背景
1. 该法可在7天内获得30-40×106个DC/小鼠,是Inaba 经典方法的7-10 倍。DC经14.5%甲泛葡胺(Metrizamide)梯度离心后,纯度(即CD11c+/I-Ab+细胞)可达85-95%。
2. 该法获得的DC 的内吞能力弱于Inaba 经典方法,但分泌的IL-12p70 量相似;
3. 该法获得的DC 在混合淋巴细胞反应中比Inaba 经典方法呈现更强的刺激能力;
4. 该法获得的DC 能引起更强的特异性T 细胞反应;
5. 综上,Son法比经典方法能获得更多、更成熟的BMDC。
培养步骤
1. 小鼠骨髓细胞的获得
见Inaba 法(改良)中的相应步骤。
2. BMDC 的大量制备
2.1 步骤1 中获得的小鼠骨髓细胞计数后用含10% FBS 的RPMI 1640 完全培养液调整细胞浓度为2× 105 /ml;
2.2 铺至6 孔培养板内,每孔5ml 细胞,同时加入重组小鼠GM-CSF (1000U/ml)和IL-4 (1000U/ml),37℃,5% CO2 培养箱培养;
2.3 在培养的第4天,向培养体系中补充重组小鼠GM-CSF (1000U/ml)和IL-4(1000U/ml);
2.4 培养的第7天收集DC,用2-4ml RPMI 1640完全培养液重悬,加至等体积的14.5%(w/v) 甲泛葡胺上,1200xg 室温离心20min;
·
【注】
·
此时的DC 为不完全成熟的BMDC,要想进一步成熟,请跳至步骤3。
·
2.5 收集中间层,并用RPMI 1640完全培养液洗3次备用。
3. BMDC 的完全成熟
3.1 步骤 2.4 中收集的BMDC,重新铺板,并向培养体系中加入重组小鼠GM-CSF(1000U/ml)和IL-4 (1000U/ml),以及LPS (1-10μg/ml)
3.2 37℃,5% CO2 培养箱培养2天,获得成熟的BMDC。
BMDC大量制备法-Lutz 法
背景
1. Lutz法与Son法相似,均可大量制备BMDC,但与Son法相比,Lutz 法更为广泛地被采用。
2. 该法可获得更多的BMDC,达1-3 x 108个DC/小鼠,而且纯度可达90-95%;
3. 该法比Son 法使用的细胞因子浓度低得多,仅为200U/ml,而且培养的第8天到第10天降为30-100U/ml,这样可以大幅节约试剂成本;
4. 该法与Inaba 经典方法和Son法的最大不同是使用细菌培养皿(Petri dish)而非细胞培养板来培养骨髓细胞。Inaba的解释是细菌培养皿不容易使骨髓中的巨噬细胞贴壁,从而抑制巨噬细胞的发育,进而避免巨噬细胞对DC 成熟的抑制作用,这可能是该法能够以较低铺板密度获得大量BMDC的主要原因。
5. 但该法的培养时间较长,需要10-12天,一方面是为了获得更多的BMDC,另一方面,大多数粒细胞和淋巴细胞很难存活这么长时间,因此可提高最终获得的BMDC 的纯度;
6. 该法仅用GM-CSF 进行诱导培养,得到的BMDC中未成熟和成熟DC均有,若要进一步提高成熟度,需用LPS或TNF-α再诱导1-2天,其中成熟DC细胞的含量将达到50-70%。
培养步骤
1. 小鼠骨髓细胞的获得
见Inaba 法(改良)中的相应步骤,注意省去溶血步骤。
2. BMDC 的大量制备
2.1 步骤1中获得的小鼠骨髓细胞计数后用含10% FBS 的RPMI 1640完全培养液调整细胞浓度为2×105/ml;
2.2 铺至100mm 细菌培养皿(Petri Dish)中,每皿10ml 细胞,同时加入重组小鼠GM-CSF (200U/ml),37℃, 5% CO2 培养箱培养;
·
【注】:
·
此处使用的是细菌培养皿,而非细胞培养板。
·
2.3 第3天时,向培养皿中再加入10ml 含20ng/ml 重组小鼠GM-CSF 的完全培养液;
2.4 第6天和第8 天分别半量换液,即收集旧培养液,离心后用含20ng/ml 重组小鼠GM-CSF 的完全培养液重悬细胞沉淀,然后再将细胞悬液放回原皿;
2.5 第10天时可收集细胞,即为BMDC。
3. BMDC 的完全成熟
3.1 培养第10天的DC用移液器轻轻吹打收集悬浮细胞,300xg 室温离心5min;
3.2 弃上清,用10ml RPMI 1640 完全培养液重悬细胞沉淀,然后铺于100 mm 细胞培养板;
3.3 加入重组小鼠GM-CSF(100U/ml )和TNF-α(500U/ml),或重组小鼠GM-CSF(100U/ml)和LPS (1μg/ml);
3.4 37℃,5% CO2培养箱继续培养1-2天。
04
BMDC的鉴定
1. 形态学观察:BMDC多数呈集落生长,细胞有多个树突样突起,成熟的BMDC 更加明显;
2. 细胞表型分析:流式细胞术检测DC 细胞表面CD11c,CD40,CD80,CD86,MHCII 类分子(I-A/I-E)等的表达,BMDC高表达这些分子,完全成熟的BMDC中这些分子的表达会进一步提高。
3. 混合淋巴细胞反应(MLR):BMDC具有较强的刺激能力,且成熟度越高,刺激能力越强。
05
成熟诱导剂该如何选择?
LPS,CD40L 和TNF-α无论对人DC 还是小鼠DC 均是常用、有效的成熟诱导剂。TNF-a 诱导DC 的成熟能力在三者中最弱。LPS 和CD40L 均是DC 体外完全成熟的强诱导剂,两者诱导DC 的成熟度相似,但诱导产生的细胞因子谱有差异。CD40L诱导成熟的BMDC 在体内显示出最强的免疫调节能力,包括保护性和治疗性肿瘤免疫反应的产生。用LPS刺激DC完全成熟所用的浓度一般为1-10μg/ml,但其实0.1 μg/ml 已经有非常强的作用,但保险起见,一般选用1μg/ml。对于CD40L 需要注意的是,CD40L 分子属于TNF 配体家族,该家族的特点是在形成三聚体后才能发挥作用。所以最好能用重组的CD40L三聚体蛋白来刺激DC,这样会有很好的效果。如果用CD40L 单体来刺激DC,多数情况下成熟度并不是很高。
06
培养方法的选择
表1.BMDC制备3种实验方法对比
|
参数 |
Inaba法 |
Son法 |
Lutz法 |
|
在PubMed被引用次数 |
783 |
24 |
663 |
|
骨髓溶血裂解红细胞 |
是 |
是 |
否 |
|
骨髓先去除淋巴细胞 |
是 |
否 |
否 |
|
培养过程中去除粒细胞 |
是 |
否 |
否 |
|
骨髓细胞最初铺板体积 |
1ml |
15ml |
10ml |
|
培养器 |
24孔细胞培养板 |
6孔细胞培养板 |
100mm细菌培养皿 |
|
培养液 |
RPMI 1640+10% FCS |
||
|
小鼠GM-CSF浓度 |
200-1000U/mL |
开始为125-1000U/mL 第4天和第7天,向培养体系中再添加足量的GM-CSF和IL-4。 |
开始为200U/mL 第10天后3-100U/mL |
|
小鼠IL-4 |
不用 |
用,浓度同GM-CSF |
不用 |
|
换液方法 |
第2天和第4天吸弃50%-75%的旧培养液(其中含有细胞),然后换含足量GM-CSF的新鲜完全培养液 |
/ |
第3天补充等体积含GM-CSF的完全培养液,第6,8和10天半量换液,吸出的旧培养液(其中含细胞)离心后用含GM-CSF的新鲜完全培养液重悬后放回。 |
|
传代前培养时间(扩增) |
6天 |
7天 |
10天 |
|
传代后培养时间(成熟) |
2天 |
无 |
1-2天 |
|
完全成熟诱导剂 |
TNF-ɑ(250U/mL) |
LPS(1-10μg/mL) |
TNF-ɑ(250U/mL)或LPS(1μg/mL) |
|
DC收获时间 |
7-8天 |
7-8天 |
10-13天 |
|
DC纯度 |
第8天:60-70% |
第7天:85-95% |
第10-12天:80-90% |
|
DC产量/小鼠 |
(5-7)×106 |
(3-4)×107 |
(1-3)×108 |
07
DC培养试剂推荐
|
产品名称 |
货号 |
规格 |
|
91108ES |
5μg/50μg/100μg/500μg |
|
|
90144ES |
5μg/50μg/100μg/500μg |
|
|
90621ES |
5μg/20μg/50μg/500μg |
|
|
94016ES |
25μg/100μg/500μg |
