
肺腺癌(LUAD)是美国癌症死亡的主要原因,诊断和治疗LUAD的一个主要挑战是肿瘤内部形态和分子的异质性。
2022年11月15日,国际顶刊Cell Reports Medicine(IF=16.988)在线发表了创新研究成果“Proteogenomic analysis of lung adenocarcinoma reveals tumor heterogeneity, survival determinants, and therapeutically relevant pathways”。该研究结合全基因组测序、转录组测序、蛋白质组学和磷酸化修饰组学等,鉴定出疾病三种亚型,包括从不吸烟者富集的高过渡型,当前吸烟者富集的高转化型,以及过往吸烟者富集的结构改变型。此外,检测并验证了预测患者生存的RNA和蛋白质的表达特征,为LUAD分子精准医疗奠定了基础。
研究材料
87例LUAD(原发肿瘤)患者,其中80%为I期或II期,83%来自吸烟患者的石蜡包埋(FFPE)切片,肿瘤的组织学亚型主要有:腺泡、乳头和实体。
技术路线
步骤1:体细胞基因组特征亚型结合分子病因与吸烟史;
步骤2:肿瘤间RNA和蛋白质相关性研究;
步骤3:转录和蛋白决定患者存活率;
步骤4:LUAD的蛋白质基因组分型;
步骤5:LUAD亚型的综合网络建模。
研究结果
1. 体细胞基因组特征亚型结合分子病因与吸烟史
根据疾病关联的体细胞基因组特征对肿瘤进行聚类并确定了三种亚型,分别为高过渡型、高转换型和结构改变型(图1A-D)。EGFR体细胞突变在高过渡型中富集,KRAS和STK11在高转化型中富集,TP53在结构改变型中最为常见。虽然TP53 的RNA和蛋白质表达在结构改变型中没有变化(图1E),但ser15磷酸化程度最高,与该亚型高SV负荷一致(图1F)。与此同时,该亚型表现出TP53突变高表达(图1G)。
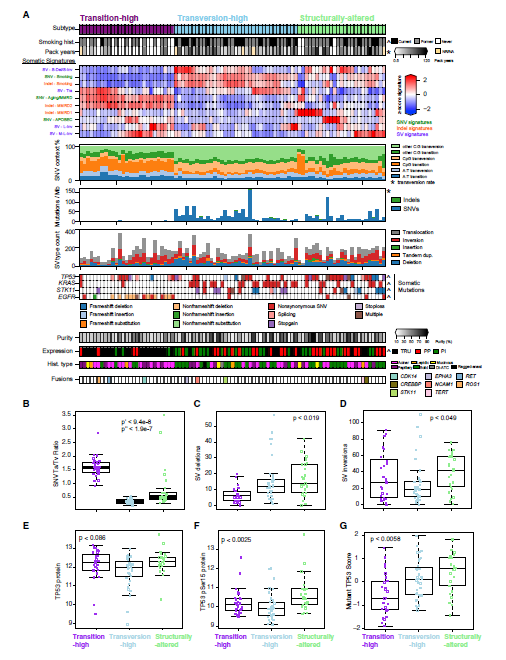
图1 通过全基因组体细胞特征对LUAD进行分型
2. 肿瘤间RNA和蛋白质相关性研究
为了比较7472个共检测基因的RNA和蛋白质表达,计算肿瘤中基因级RNA:肿瘤间蛋白相关性。中位基因相关性为0.47,84%的基因呈正相关(图2A)。APOLLO队列的中位基因相关性与LUAD CPTAC队列相似。独立LUAD队列之间的基因级RNA:蛋白质相关性值呈显著正相关(图2 B)。高相关性基因富集于细胞粘附和RAS信号通路,低相关性基因富集于翻译起始和氧化磷酸化(图2C)。其后,发现并验证了免疫富集的LUAD肿瘤与高纯度肿瘤相比,其RNA和蛋白质水平具有更大的变异性(图2D)。
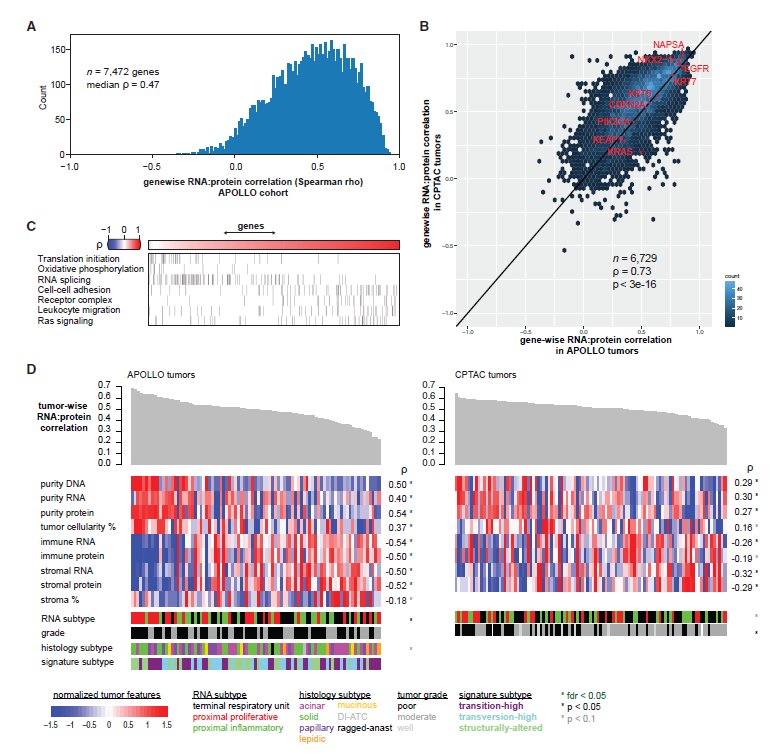
图2 基因、肿瘤RNA和蛋白质表达的相关性
3. 转录和蛋白决定患者存活率
通过MFS(无转移生存率),确定了560个“存活蛋白”和155个“存活RNA”显著相关。所有共表达的蛋白质和RNA都与 MFS风险比显著相关(图3A)。将生存蛋白和相应的对数风险比作为权重组合成蛋白生存特征,发现这些蛋白总表达可通过OS(患者总生存率)和MFS区分患者(图3B)。存活基因组之间的基因RNA:蛋白质相关性存在显著差异(图3C)。又通过CPTAC和APOLLO队列验证,发现LUAD患者的OS和MFS可通过独立队列的蛋白和RNA表达来预测(图3D,3E)。
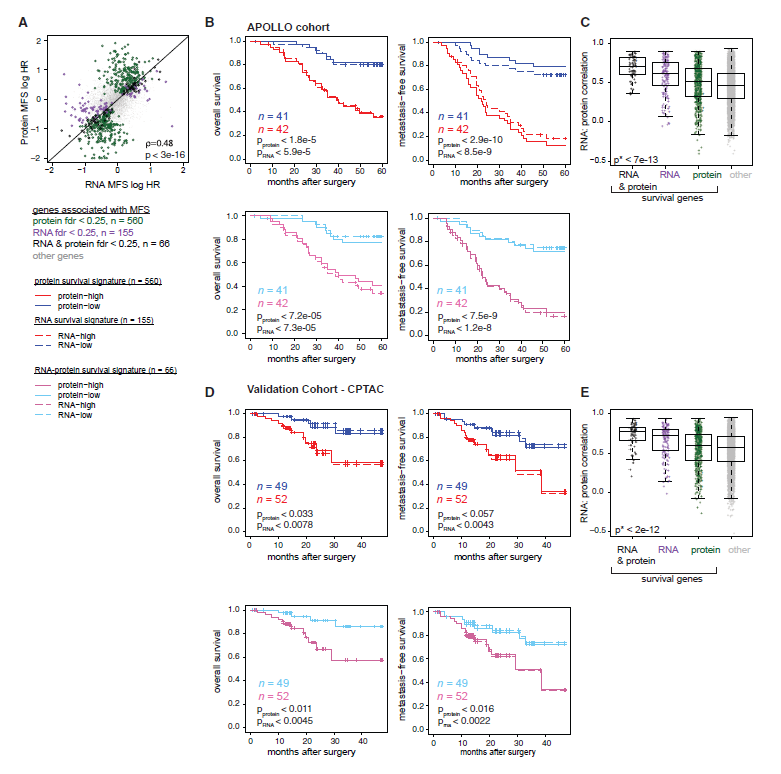
图3 RNA和蛋白质表达决定患者生存
4. LUAD的蛋白质基因组分型
通过RNA表达将肿瘤划分为TRU、PI和PP亚型,这些亚型存在不同组织学特征TRU(腺泡)、PI(实体)(图4A)。整合RNA、蛋白质和磷酸化数据分析,在各亚型中确定了不同的过表达通路,TRU蛋白分泌及脂肪、肌肉形成的发育通路过表达,PI炎症和干扰素-γ信号通路过表达,PP增殖相关通路过表达(图4B)。比较肿瘤亚型与患者生存结局,发现表达亚型、组织学亚型与MFS显著相关(图4C)。
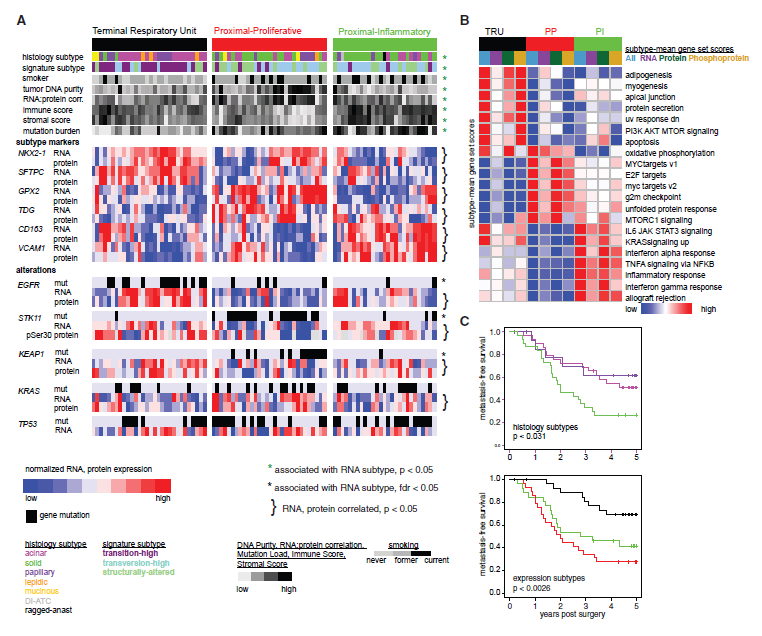
图4 分子亚型特征和生存结果
5. LUAD亚型的综合网络建模
利用磷酸化修饰组学和已知激酶底物互作推断肿瘤中的激酶活性,确定各亚型激酶活性富集评分(图5A)。然后,将已知的激酶底物、蛋白质-蛋白质和蛋白通路互作等信息整合到分型特异性网络模型中,发现PI的网络特征是驱动IFN-γ信号传导和炎症分子互作,TRU是EGFR信号过度活跃,PP是在免疫冷微环境中细胞周期和糖酵解生物过程增强(图5)。
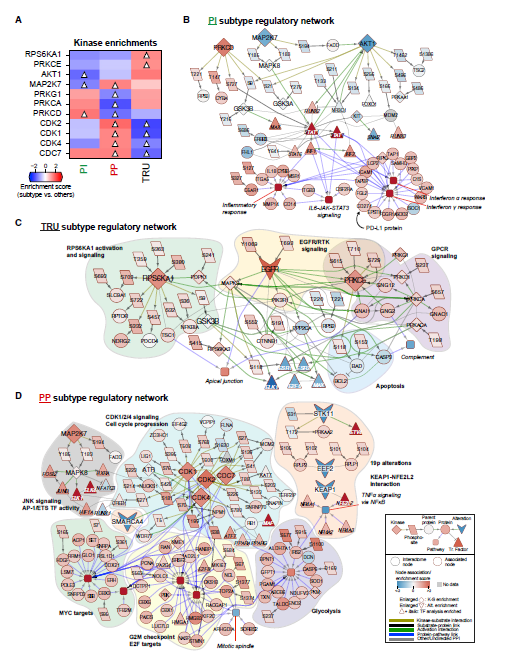
图5 各亚型的蛋白质基因组网络特征
小编小结
该研究报道了来自美国肺腺癌的蛋白质基因组学特征,通过分子分型扩展了疾病病因,并将RNA和蛋白的表达相关性与肿瘤免疫含量联系起来,综合分析揭示了分子亚型之间患者生存特征和治疗干预靶点。
