食管鳞状细胞癌(OSCC)作为食道癌最常见的亚型(84%),仍然是全球肿瘤死亡的主要原因。东亚特别是中国的OSCC具有较高的发病率。由于缺乏典型的临床症状和早期诊断技术,许多OSCC患者被诊断为晚期,不得不接受以顺铂(DPP)为基础的化疗,但其高耐药率限制了临床应用疗效,其源头机制尚不清楚。本研究的目的是阐明信号传递和代谢异常在食管鳞癌耐药中的作用,寻找提高顺铂化疗敏感性的靶向药物。
2023年3月,同济大学附属东方医院的徐美东教授与团队在Journal of Experimental & Clinical Cancer Research (IF=12.658)期刊上发表题为“Targeting IGF1R signaling enhances the sensitivity of cisplatin by inhibiting proline and arginine metabolism in oesophageal squamous cell carcinoma under hypoxia”的文章,该研究揭示了通过IGF1R途径上调ASS1和PYCR1的表达,靶向精氨酸和脯氨酸代谢,促进OSCC对DDP的耐药,提示靶向IGF1R信号转导的Linsitinib可能为DPP耐药的OSCC患者提供有前景的联合治疗选择。(麦特绘谱提供Q300全定量代谢组检测服务)

OSCC患者IGF1R的表达在DDP耐药中的作用
研究者通过转录组测序(RNA-seq)、肿瘤基因组图谱(TCGA)数据库、免疫组织化学(IHC)、实时定量聚合酶链式反应(RT-qPCR)和免疫印迹(WB)检测食管鳞癌组织中上调基因的表达。分析发现食管鳞癌组织中胰岛素样生长因子-I受体(IGF1R)表达差异最显著,并且高表达水平的IGF1R与肿瘤进程和预后差呈正相关,与缺氧条件下DDP抵抗有关。
随后通过干扰IGF1R的表达探究其异常表达在DDP耐药中的作用,体内体外实验均发现了适度抑制OSCC增殖的能力。使用linsitinib联合DDP对OSCC细胞的增殖具有协同抑制作用,这些协同效应在体外和体内也得到了体现。总的来说,抑制IGF1R的表达可显著提高OSCC细胞对DDP的敏感性。
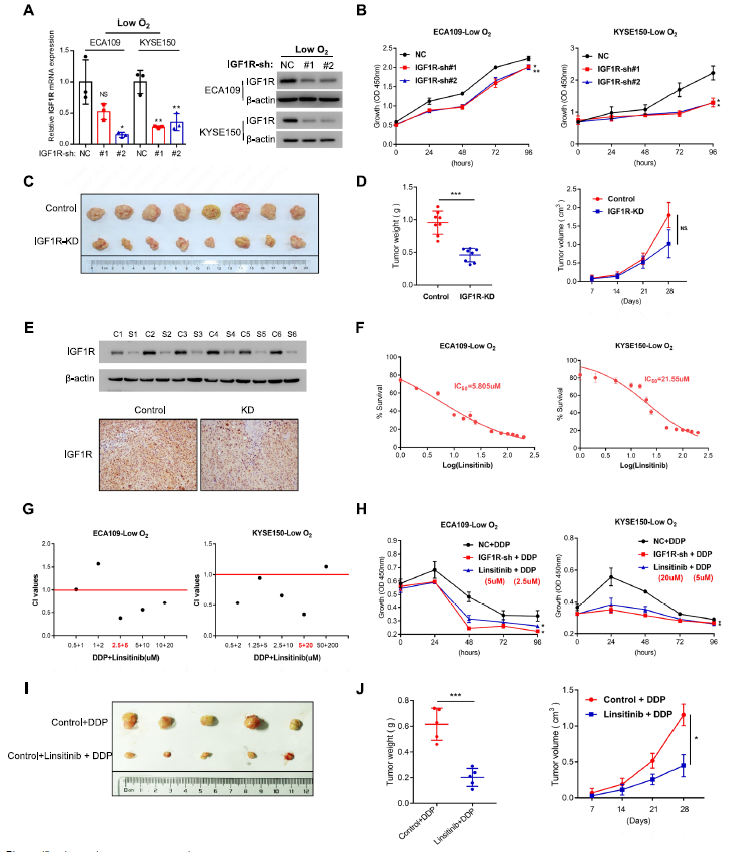
图1. 体内和体外抑制IGF1R可增强OSCC在对DDP的敏感性
耐药机制探讨
代谢适应有助于癌细胞在缺氧微环境中的发育。接下来,通过整合代谢组学和基因组学分析,旨在找到缺氧条件下活化的代谢酶。一方面,在缺氧条件下,精氨酸琥珀酸合成酶1(ASS1,精氨酸代谢关键酶)和吡咯烷-5-羧酸还原酶1(PYCR1,负责脯氨酸合成)在肿瘤组织和细胞系中均有高表达。另一方面,代谢组学分析(Q300全定量代谢组技术)在细胞系中发现了45种异常积累的代谢物,通路分析显示TCA循环和FAO被抑制,而糖酵解增强,这可能是缺氧导致ATP生成的稳态机制;另外,天冬氨酸-精氨酸-脯氨酸代谢也得到增强。该团队此前研究天冬酰胺合成酶(ASNS),发现在OSCC中存在异常的天冬氨酸代谢,因此,本研究主要关注通过ASS1和PYCR1改变精氨酸/脯氨酸代谢。
首先发现ASS1和PYCR1在OSCC细胞系中表达最高,这与IGF1R一致,缺氧也以时间依赖性的方式刺激了这两种酶的表达。此外,与癌旁组织相比,OSCC患者组织中ASS1/PYCR1蛋白表达上调,临床上ASS1/PYCR1的高表达与肿瘤分期以及OSCC患者的无进展生存期相关,并且ASS1和PYCR1的表达与IGF1R呈正相关。那么ASS1和PYCR1是否受IGF1R的调控?
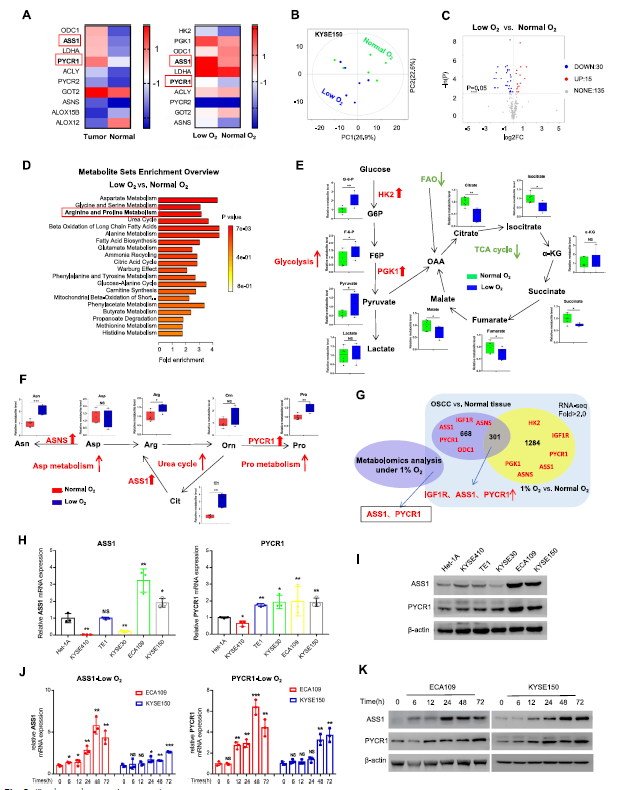
图2. OSCC中代谢酶ASS1和PYCR1上调
进一步探究IGF1R调控ASS1和PYCR1表达的机制,通过体内体外抑制IGF1R的表达,发现ASS1/PYCR1均下调。信号通路分析发现,Ras/MAPK通路(促进多种细胞功能)和JAK/STAT通路的磷酸化水平显著降低。此外,JAK和ERK1/2的下调伴随着ASS1/PYCR1表达的降低,证实IGF1R通过这两条信号通路调控ASS1/PYCR1。进一步确定这些转录因子(TFs)在缺氧时调节肿瘤代谢中的作用,发现只有磷酸化的c-MYC与ASS1/PYCR1通路和IGF1R通路有明确的调节关系。因此,缺氧条件下ASS1和PYCR1的表达改变是由IGF1R信号通路–c-MYC轴诱导的。
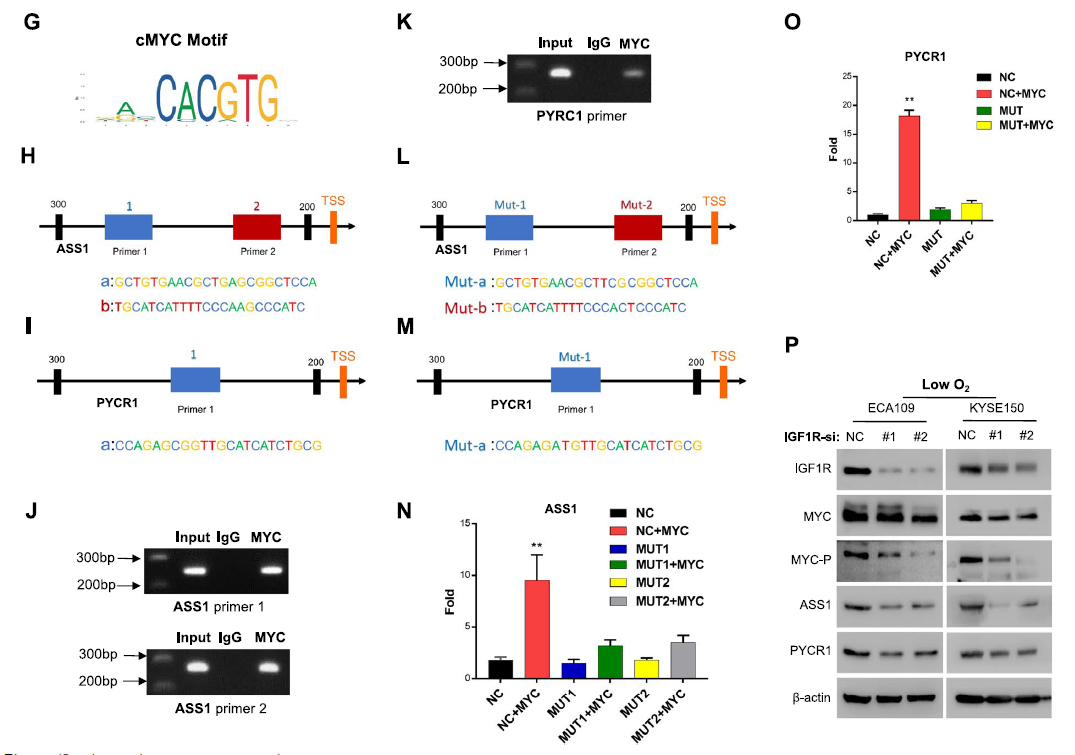
图3. IGF1R通过其信号通路- c- MYC轴在缺氧条件下调控ASS1和PYCR1的表达
靶向精氨酸代谢/脯氨酸代谢的作用
为了进一步研究ASS1和PYCR1增强在DDP耐药中的作用,通过干扰ASS1和PYCR1的表达,观察到在体外和体内的增殖能力受到轻微抑制。与IGF1R抑制剂linsitinib的作用一致,shASS1/PYCR1在体外和体内均表现出与DDP协同抑制肿瘤增殖的作用。
利用代谢组学分析ASS1和PYCR1在代谢重编程中的作用,ASS1和PYCR1抑制诱导的异常与精氨酸/脯氨酸代谢密切相关。更具体地说,shRNA-PYCR1细胞中的脯氨酸水平降低,shRNA-ASS1细胞中的精氨酸水平降低。此外,与对照组(control+DDP)相比,补充外源精氨酸后shASS1 + DDP或linsitinib + DDP被抑制的增殖能力得到部分恢复。这些数据表明,IGF1R在缺氧条件下通过调节ASS1促进精氨酸代谢,导致精氨酸积累,作为维持化疗期间增殖能力的生物合成前体。
然而,外源脯氨酸在shPYCR1 + DDP或linsitinib + DDP组中未能挽救增殖,说明增强的脯氨酸代谢可能以其他方式促进肿瘤细胞对DDP的抵抗,而不是脯氨酸的积累。
已有研究证实,PYCR1催化脯氨酸合成伴随着NAD+的生物合成,在维持氧化还原平衡中起着关键作用。理论上,低氧对TCA循环的损害不仅会导致ATP生成减少,还会导致多种中间代谢物在TCA循环中的积累减少,从而抑制合成代谢前体的合成,最终抑制细胞增殖。那么通过PYCR1增强脯氨酸代谢的NAD+是否补偿了TCA循环?结果正如预期,PYCR1表达的减弱抑制了NAD+水平。最后,在DDP+shPYCR1中添加外源性丙酮酸,逆转了shPYCR1+DDP对细胞增殖的抑制作用。因此,IGF1R通过调节PYCR1促进脯氨酸代谢,提供足够的NAD+维持TCA循环中的氧化还原平衡,最终造成化疗期间的细胞增殖,靶向IGF1R信号通路可逆转其影响。
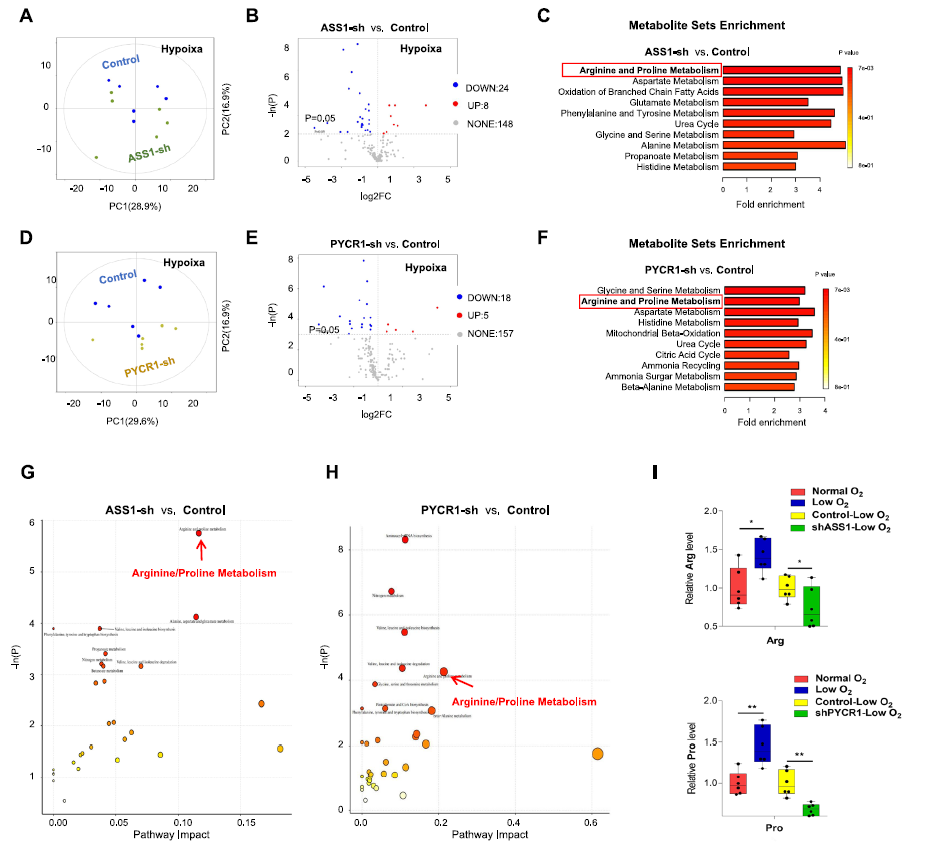
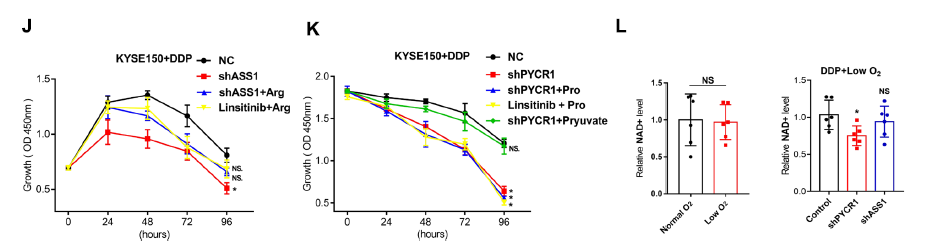
图4. 低氧条件下IGF1R通过靶向的精氨酸和脯氨酸代谢降低OSCC细胞对DDP的敏感性
小结
本研究发现激活的IGF1R通路在低氧微环境下的OSCC化疗耐药中发挥重要作用。临床上,IGF1R表达增强与OSCC患者肿瘤分期高、预后差相关,其抑制剂linsitinib在体内和体外均与DDP治疗有协同作用。由于缺氧常导致代谢重编程,研究人员通过代谢组学分析进一步了解到,异常的IGF1R通路通过c-MYC的转录活性促进代谢酶ASS1和PYCR1的表达。具体而言,ASS1的表达增强促进精氨酸代谢以进行生物合成代谢,而PYCR1则激活脯氨酸代谢以维持氧化还原平衡。最终,异常信号传递结合代谢重编程导致DDP耐药性。因此,靶向IGF1R通路及相关代谢改变可能改善DDP在OSCC中的治疗效果,或可成为一种基于DDP的更有效的化疗新策略。
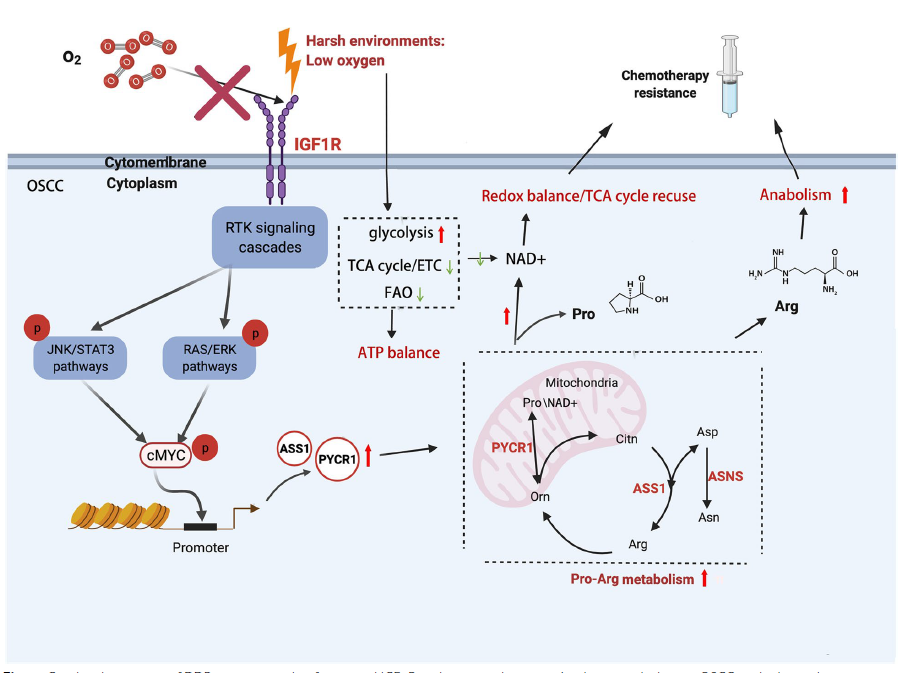
图5. 本研究图解总结
参考文献
Kang Fang et al. Targeting IGF1R signaling enhances the sensitivity of cisplatin by inhibiting proline and arginine metabolism in oesophageal squamous cell carcinoma under hypoxia. J Exp Clin Cancer Res. 2023 Mar 28;42 (1):73.
请扫描二维码阅读原文

绘谱帮你测
为了满足肿瘤快速生长对生物能量,生物合成和氧化还原的高度需求,肿瘤组织发生代谢重编程,其过程中细胞内外的小分子代谢产物对基因表达,细胞分化和肿瘤微环境产生直接或间接调控作用。因此测准代谢物变化已成为研究肿瘤代谢重编程的重要切入点,麦特绘谱深耕靶向定量代谢组学的创新性方法开发,高效研发出高通量定量准的Q300,Q500,Q1000等全定量代谢组方法,经过10万例+样本的验证,已成为深入挖掘功能机制和临床转化产品开发的基石,获得业内专家学者们的高度认可。截至2023年5月,Q300技术已协助客户发表60余篇SCI文章,平均IF>10,成果涵盖肿瘤/癌症、代谢性疾病、免疫疾病、神经系统性疾病、衰老、环境毒理学、中医中药等研究领域。
麦特绘谱专注于代谢组学与转化医学疾病研究领域,拥有成熟的代谢组学检测平台,以全定量靶向代谢组学技术为核心,包括全球独有技术Q1000,Q500、Q300、Q200和各类小分子代谢物单独检测方法共20+系列,兼顾非靶和广靶。同时还有菌群16S测序、宏基因组学、转录组学和蛋白质组学等多组学及联合分析等全套解决方案。独家的检测技术、全面的数据报告及专业科研级别的售后探讨,助您科研探索之路不断创新和突破。欢迎联系获取详细资料!
往期回顾
1. Cell Metabolism | 肠癌免疫治疗疗效差,氨积累惹的祸!
2. 客户案例 | IF 19.87:胞外酸中毒限制T细胞一碳代谢以保护其细胞干性
3. Cancer Cell | 花生四烯酸与IFNγ协同诱导肿瘤铁死亡的新机制
4. Nature | 菌群代谢物3-IAA有望大大提升胰腺癌化疗疗效!
5. Nature Immunology | CD8+T细胞通过尿素和瓜氨酸循环解氨毒以促进自身记忆发育
6. 客户案例 | PNAS:β-arrestin 1在介导胃癌细胞代谢和增殖中的双重作用

