
课题概述
合成代谢是工程细菌的负担之一,但其内部机制并不明晰。本研究结果表明转录因子Cra活性失调导致甘油过量合成是大肠杆菌生长负担的重要原因。甘油的合成会降低1,6-二磷酸果糖水平并激活Cra,从而抑制糖酵解相关酶的活性和促进糖异生相关酶活性。由于细胞生长依赖葡萄糖的供应,糖异生过程的不当激活和糖酵解过程的抑制可能会导致甘油通路诱导作用下损害细胞生长。德国马克斯·普朗克陆地微生物研究所Hannes Link团队通过在甘油通路限速酶表达的启动子中设计了一个Cra结合位点以维持足够高的1,6-二磷酸果糖水平。作者设计了一组成型的诱导型启动子,并在大肠杆菌中过量合成了类胡萝卜素,从而证明了该方法的普适性。相关成果发表在《Nature communications》。
1. 甘油过量合成导致大肠杆菌的生长负担
为了研究合成代谢途径如何影响宿主的代谢过程,作者在大肠杆菌中过表达甘油生物合成途径。甘油通路是从糖酵解代谢物磷酸二羟丙酮开始的两步反应。第一步反应由3-磷酸甘油脱氢酶(GPD1)催化,将磷酸二羟丙酮转化为3-磷酸甘油。第二步反应在3-磷酸甘油磷酸水解酶(GPP2)催化下,3-磷酸甘油去磷酸化生成甘油。用于合成甘油的大肠杆菌菌株从质粒中表达了编码gpd1和gpp2的两个基因,并缺乏甘油激酶基因(glpK)防止甘油作为碳源被利用。其中gpd1由pBAD启动子(阿拉伯糖诱导)调控,而gpp2由pJ23101启动子调控。在生长负担调控研究中,发现pBAD启动子能够线性促进蛋白表达。然而,根据通量平衡分析,pBAD启动子无法调控生长速率和甘油合成效率。但是,甘油通路诱导作用下,生长速率下降幅度比通量平衡分析要剧烈得多,如图1所示。

图1 甘油过量合成导致大肠杆菌的生长负担
2. 甘油合成通过降低1,6-二磷酸果糖水平来激活转录因子Cra
为探讨导致菌株生长负担的分子机制,作者对0、0.1 和 0.5%阿拉伯糖诱导下的代谢组变化进行分析。共检测到96种代谢物,这些代谢物在0.1%阿拉伯糖诱导下保持相对恒定,但在0.5%阿拉伯糖诱导时显示出强烈变化。其中,0.5%阿拉伯糖诱导时,甘油通路的直接前体磷酸二羟丙酮(DHAP)下降最强烈。此外,磷酸二羟丙酮上游代谢物1,6-二磷酸果糖(FBP)也是变化最明显的代谢物之一。FBP可激活转录因子Cra,进而抑制糖酵解酶相关基因表达和促进糖异生酶相关基因表达。低浓度FBP是否可以激活Cra从而调控基因表达和酶活性。Cra敲除菌株作为对照组,对各实验组38个蛋白进行分析,发现0.5%阿拉伯糖组磷酸烯醇丙酮酸合成酶(PpsA)出现显著上调,而甘油醛-3-磷酸脱氢酶(GapA)显著降低。由此说明,0.5%阿拉伯糖诱导甘油通路可降低FBP浓度从而激活Cra,导致GapA活性降低(糖酵解相关酶)、PpsA活性增加(糖异生相关酶)。
由于菌株在含有低葡萄糖浓度培养基里生长,由此假设糖异生激活是生长负担的重要原因,并进行了证实。此外,在甘油通路高诱导下,Cra敲除菌株比基础菌株生长得更好。因此,Cra可以调控甘油过量合成造成大肠杆菌的生长负担。
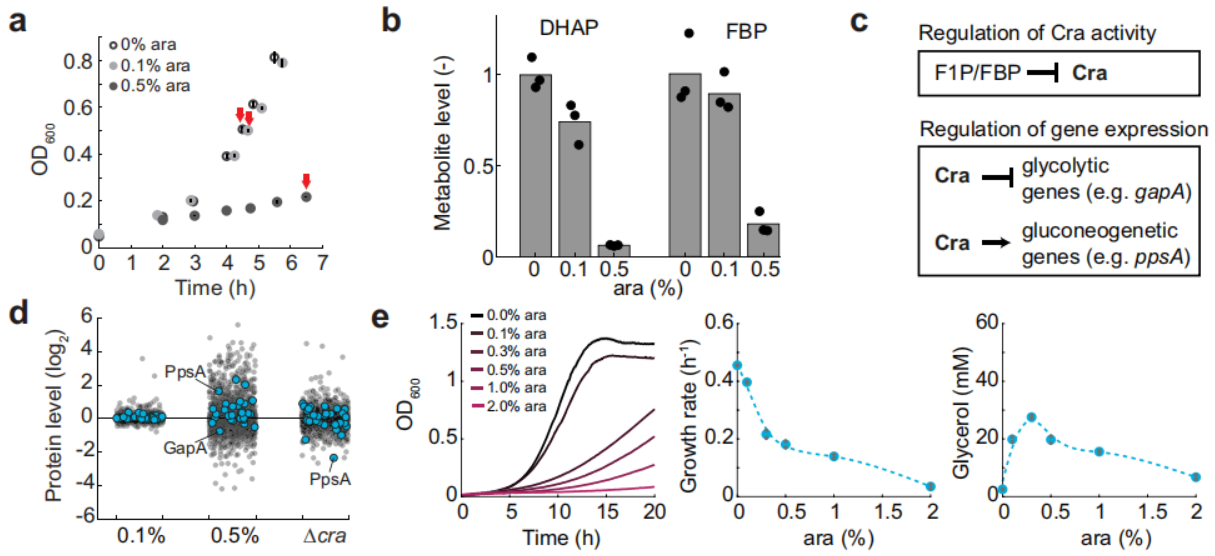
图2 甘油通路的诱导激活转录因子Cra
3. 代谢模型预测甘油合成最优策略
为进一步表明Cra转录是调控甘油合成的一个因素,作者开发了一个小型动力学模型。如图3所示,该模型包含一种代谢物(1,6-二磷酸果糖)和两种酶(GapA和GPD1)。根据Michaelis-Menten动力学,1,6-二磷酸果糖影响糖酵解和甘油通路的反应速率。作者假设模型中有恒定的流入,并将糖酵解上限反应速率固定为4.9 mmol/g/h,意味着1,6-二磷酸果糖以恒定速率合成从而用于甘油合成或者生物物质合成。构建三个不同的模型(基本模型、Δcra模型、2xcra模型)进行分析,分析结果显示2xcra模型最优,可获得高甘油通量。因此,模型分析认为将Cra调控不同酶活性可能会使甘油合成率增加。
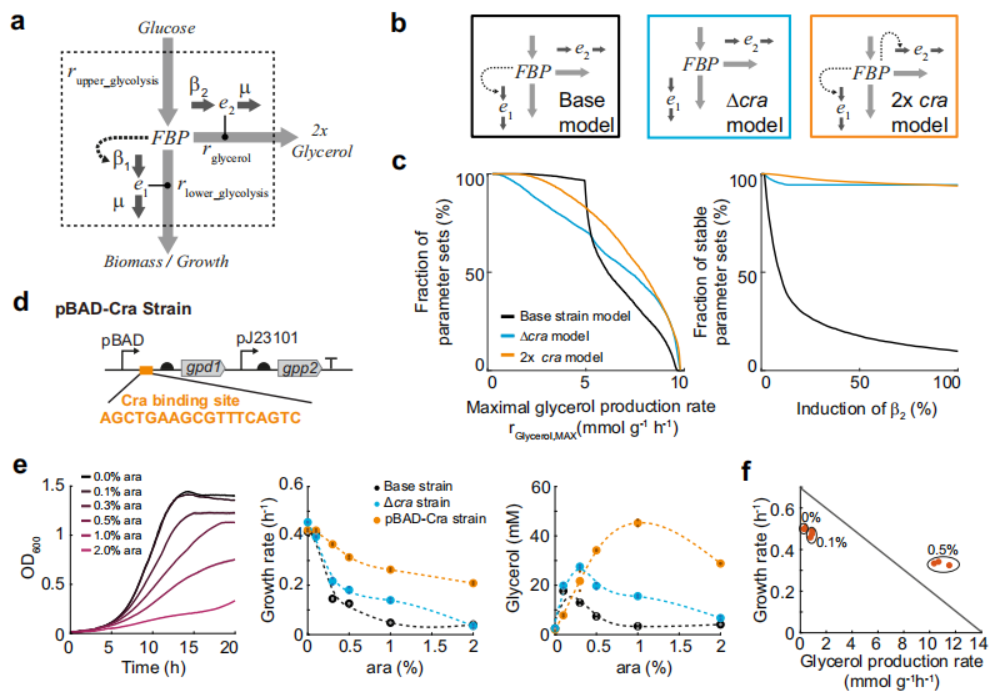
图3 Cra调控下的pBAD启动子促进甘油合成的理论和实验分析
4. Cra调控的pBAD启动子可改善生长速率和甘油合成
研究中发现Cra可抑制pBAD-Cra启动子,为证明pBAD-Cra启动子功能,检测野生型和Δcra菌株中pBAD启动子和pBAD-Cra启动子活性。结果发现,野生型菌株中,pBAD-Cra启动子活性低于pBAD启动子,说明Cra对启动子有抑制作用。而在Δcra菌株中,pBAD-Cra启动子的活性略高于pBAD启动子。这些结果表明Cra抑制pBAD-Cra启动子,而这种调控作用在没有Cra存在的情况下不发挥作用。因此,pBAD-Cra的低活性并不仅仅是因为序列改变,而是由于Cra主动抑制。
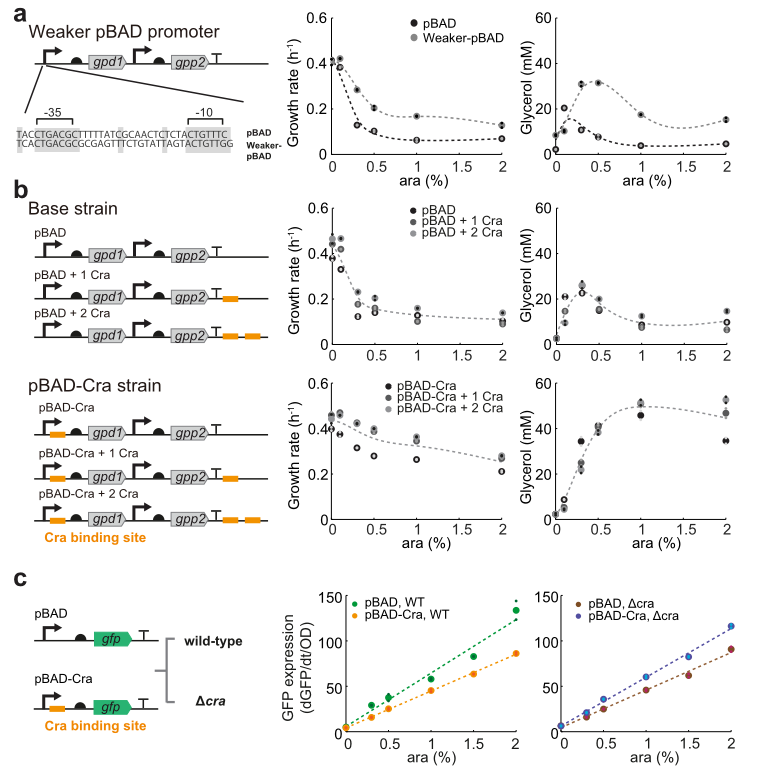
图4 Cra对pBAD启动子的调控作用
5. 高甘油通量下Cra调控pBAD启动子维持高1,6-二磷酸果糖水平
为了深入探讨Cra调控的动态规律,作者考察了甘油通路诱导下代谢组和蛋白质组的变化情况。如图5所示,pBAD-Cra菌株可以在较高的甘油合成速率下维持较高的1,6-二磷酸果糖水平。这表明1,6-二磷酸果糖和Cra之间的相互作用抵消了1,6-二磷酸果糖的下降趋势。其一,如果1,6-二酸果糖水平低于临界值则Cra活性增加;其二,过高的Cra活性会抑制pBAD-Cra启动子活性并抑制GPD1表达;其三,GDP1过低表达将恢复1,6-二磷酸果糖最初的浓度。因此,这种反馈调节机制不仅使1,6-二磷酸果糖维持在较高水平,提高甘油合成速率,而且能阻止大肠杆菌从糖酵解到糖异生的代谢转变。
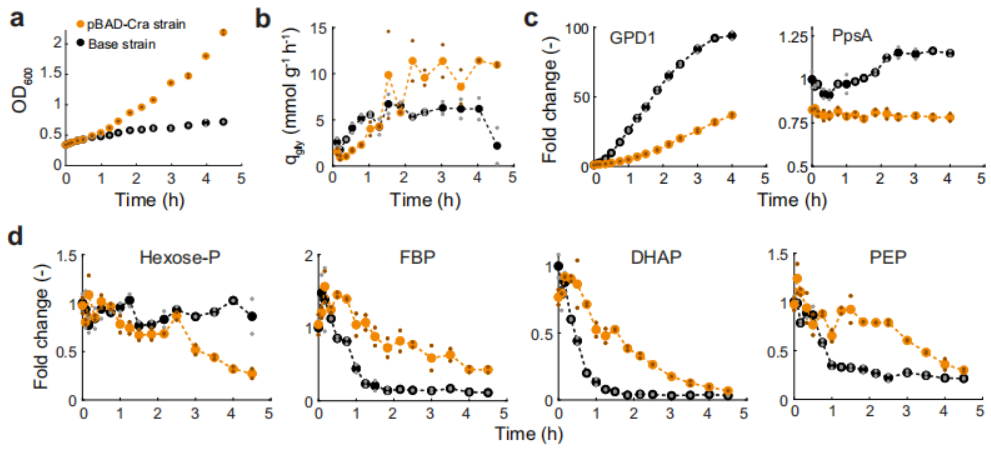
图5 甘油通路诱导的代谢物和蛋白质含量变化情况
6. Cra调控促进类胡萝卜素过表达型大肠杆菌的生长
由于很多生物物质合成以糖降解代谢物为前体,为考察该调控机制的普适性,作者利用pBAD启动子来调控类胡萝卜素合成与代谢途径(如图6所示)。类胡萝卜素生物合成从糖酵解代谢产物丙酮酸和3-磷酸甘油醛开始,通过大肠杆菌的甲基赤藓醇磷酸化途径转化为法尼基焦磷酸,法尼基焦磷酸进一步转化为类胡萝卜素。甲基赤藓醇磷酸途径两种酶(Dxs和Dxr)是从质粒中过度表达的两种pBAD启动子,分别称为pController和pController-Cra。类胡萝卜素途径的其它酶(CrtE/B/I/Y/Z)由另一个质粒(p胡萝卜素)利用拟南芥原生启动子进行表达。结果显示Cra调节的启动子在合成类胡萝卜素途径高诱导水平下可以维持更高的生长速度,并且高诱导剂不影响细胞生长和生成速率。这表明,Cra调控的pBAD启动子具有广泛的普适性,通过糖酵解代谢物调控其他合成途径成为可能。
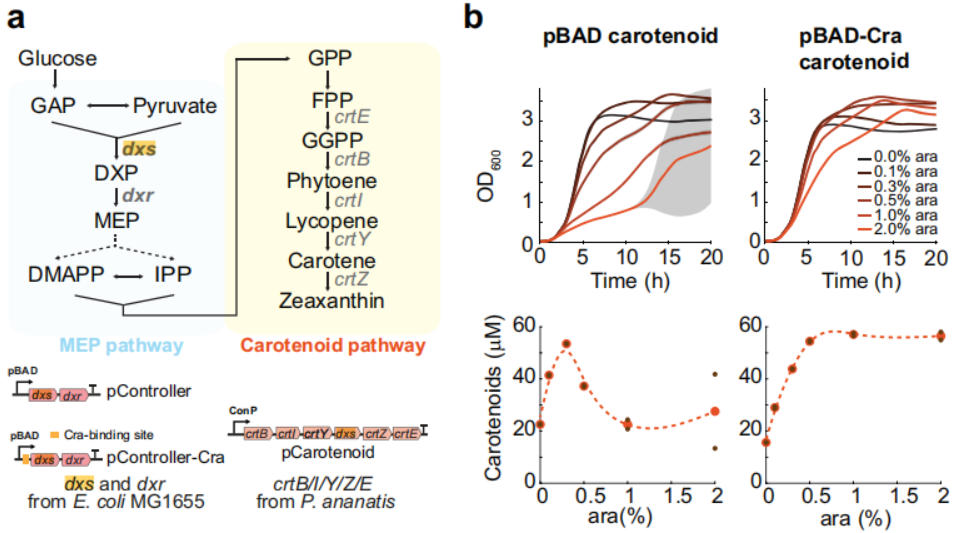
图6 Cra调控的pBAD启动子可促进类胡萝卜素的大量合成
总结
本研究中,作者使用阿拉伯糖诱导的pBAD启动子来调控大肠杆菌的合成代谢途径。虽然在GFP表达的情况下,pBAD启动子显示出诱导剂浓度和表达率之间具有线性关系,但没有观察到甘油过量产生。在该情况下,诱导剂少量增加就可造成巨大的生长负担且合成效率降低,最终导致包括甘油在内的各生物活性成分浓度降低。研究者通过代谢组学和蛋白质组学来探讨了Cra对pBAD启动子调控及宿主代谢水平的影响。从生物技术前景来看,该方法将有助于改良菌株合成技术,使其能够有效应对工业规模生物反应器等外部干扰和基因表达等内部干扰。
参考文献
Chun-Ying Wang, et al. Metabolome and proteome analyses reveal transcriptional misregulation in glycolysis of engineered E. coli. Nature Communications . 2021. https://doi.org/10.1038/s41467-021-25142-0.
原文阅读,请扫描下方二维码

特约作者
张定坤,四川大学华西医院助理研究员兼博士后,研究方向为代谢组学。
绘谱帮你测
本研究利用代谢组学结合蛋白组学检测与分析技术揭示了转录因子活性失调对于大肠杆菌糖酵解过程的影响。麦特绘谱拥有业内强大的Q600全定量代谢组、Q300全定量代谢组、Q200宏代谢组等方法,可提供代谢组学一站式整体解决方案,独家的检测技术、全面的数据报告以及专业的售后探讨,助力您的科研探索之路不断创新和突破。详情欢迎咨询麦特绘谱热线400-867-2686,获取详细资料!
往期回顾
2. Cell Metabolism | 果糖代谢与功能(二)
4. Cell Metabolism︱丙酮酸-乳酸代谢轴异常诱发心肌肥大和心衰
5. Cell Metabolism | 中国代谢研究:现在与未来
6. Nature Reviews Cancer | 肿瘤代谢最全解析
8. Protein & Cell | 肠道菌群及其代谢物在代谢性疾病中的作用

