

研究材料
技术路线
步骤1:HFHC饮食诱导的NASH小鼠肝脏中存在促炎性B细胞的聚集和活化,而B细胞缺陷小鼠的肝脏炎症和纤维化得到改善
步骤2:MyD88是B细胞在NASH过程中促进肝脏炎症、纤维化和损伤所必需的;
步骤3:NASH中的B细胞活化受到B细胞受体信号,提示B细胞活化整合了天然免疫和适应性免疫机制;
步骤4:移植NASH患者粪菌增加了受体小鼠肝脏中的B细胞积累和活化,从而加剧NASH,提示肠道菌群因素驱动了B细胞在NASH中的致病性。
研究结果
为了确定肝内B细胞在NASH进展中的作用,作者用HFHC饮食诱导小鼠NASH,并分离出免疫细胞后识别主要的免疫细胞群,HFHC组的B细胞显著增加。为了评估B细胞中细胞因子的表达情况,作者发现分别在丙二醇甲醚醋酸酯(PMA)和脂多糖(LPS)刺激后,NASH小鼠表达TNF-α和IL-6的B细胞数量增加。同时,来自NASH小鼠的B细胞也显示出细胞表面主要组织相容性复合物 (MHC) I类和II类以及CD86的上调,这表明活化和抗原呈递能力增加。以上结果表明,NASH小鼠中肝内B细胞积累,并释放促炎细胞因子以及呈递抗原的能力增加。
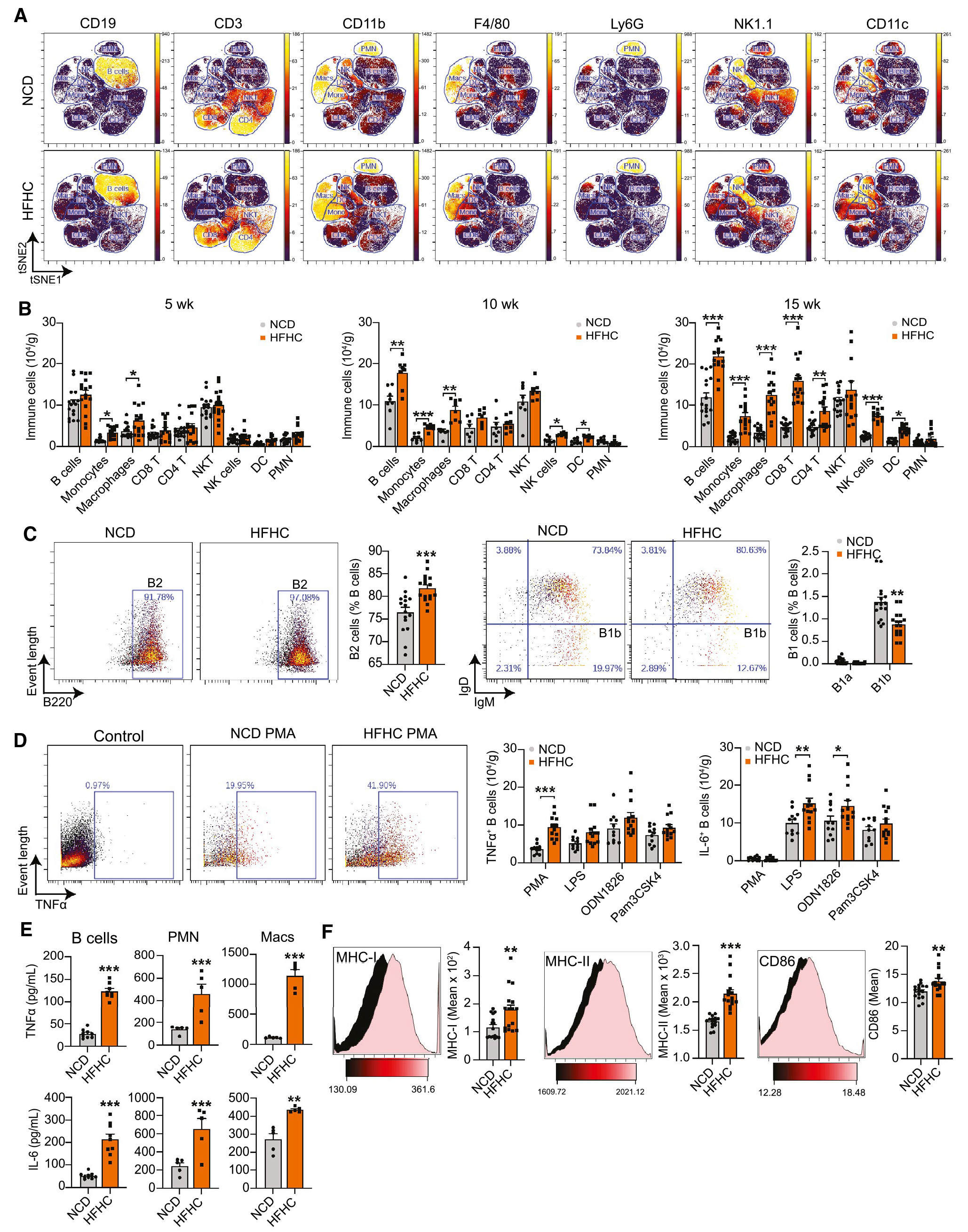
图1 促炎性B细胞在NASH小鼠的肝脏中积累
2. NASH小鼠肝内B细胞显示促炎基因谱
为了更好地了解NASH如何改变B细胞的转录组谱,作者对来自NCD和HFHC肝脏的免疫细胞进行了单细胞转录组测序,发现24个CD45+免疫细胞簇。作者主要关注了B细胞簇的基因表达谱,发现炎症基因Il1b、S100a8等在HFHC肝脏B细胞中表达增加。为了验证单细胞转录组对B细胞表达谱的检测能力,作者还对HFHC和NCD小鼠肝脏B细胞进行了常规RNA-seq,同样验证了几个促炎基因在HFHC肝脏B细胞中上调。为了解释这些数据的生物学意义,作者使用 Ingenuity Pathway Analysis (IPA) 来检测基因表达模式,发现参与炎症和TLR信号传导的上游调节因子的激活,以及IL10RA和SOCS1的抑制,并且富集到活跃的炎症途径。以上结果显示NASH小鼠的B细胞活化和炎症表型增加。
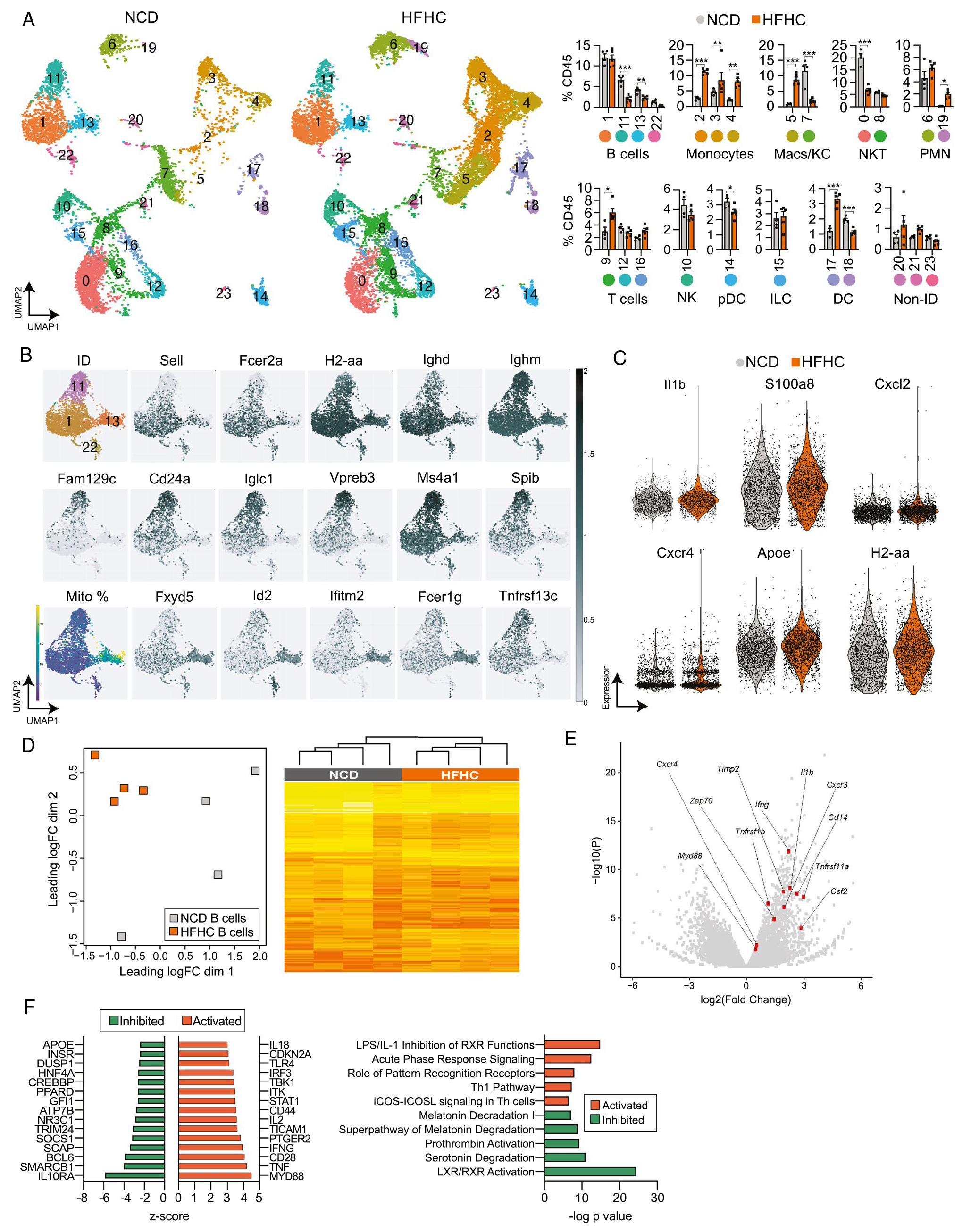
图2 肝内B细胞在NASH期间显示出促炎基因谱
3. B细胞缺陷可改善NASH
为了确定B细胞是否在NASH的发病机制中起直接作用,作者评估了HFHC喂养的B细胞缺陷μMT小鼠的NASH进展。HFHC μMT小鼠显示出NAS评分较低,且转录组数据表明,在HFHC μMT小鼠中,促炎基因的表达显著降低,B细胞数目显著减少,并且HFHC μMT小鼠纤维化明显减少,纤维化形成基因表达降低,而这些变化在NCD WT和NCD μMT小鼠中并未检测到,该结果说明在HFHC喂养后,B细胞可以引起代谢和炎症紊乱。
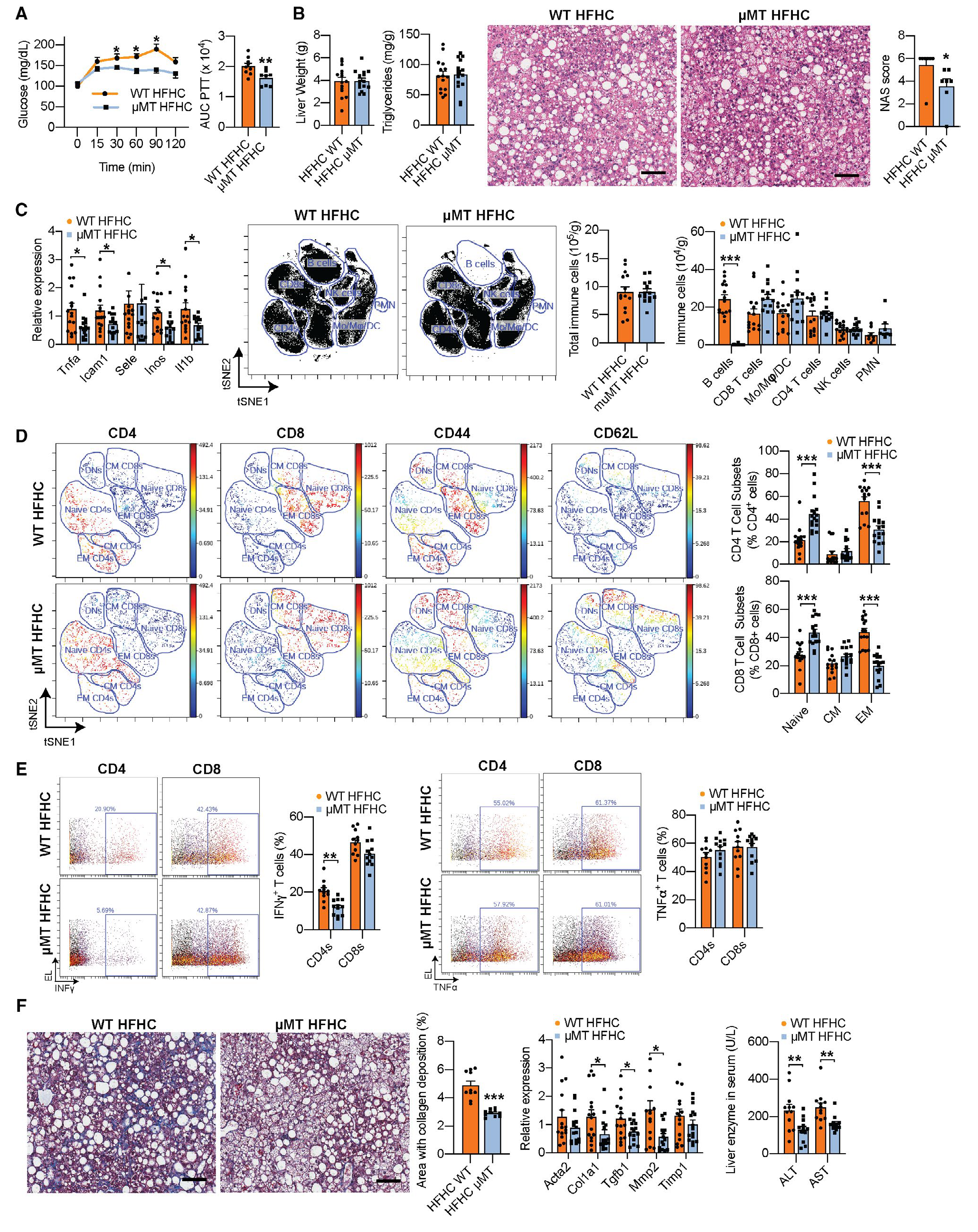
图3 B 细胞缺乏可改善NASH期间的炎症和纤维化
4. 促炎基因MyD88介导NASH中B细胞的促炎功能
RNA-seq分析确定MyD88是HFHC小鼠肝B细胞中促炎基因的上游调节因子,为了研究B细胞固有的MyD88信号传导是否影响NASH进展,作者构建了B细胞特异性缺失 MyD88 (B-MYD) 的小鼠,HFHC喂养后发现B-MYD HFHC小鼠NAS评分较低。虽然B-MYD HFHC和WT HFHC小鼠之间的总数和亚群免疫细胞群没有差异,但B-MYD HFHC小鼠的肝内B细胞MHC-I和MHC-II减少,这表明TLR介导的激活降低了抗原的呈递能力。以上结果表明,B细胞需要MyD88来促进NASH的肝脏炎症、纤维化和损伤。
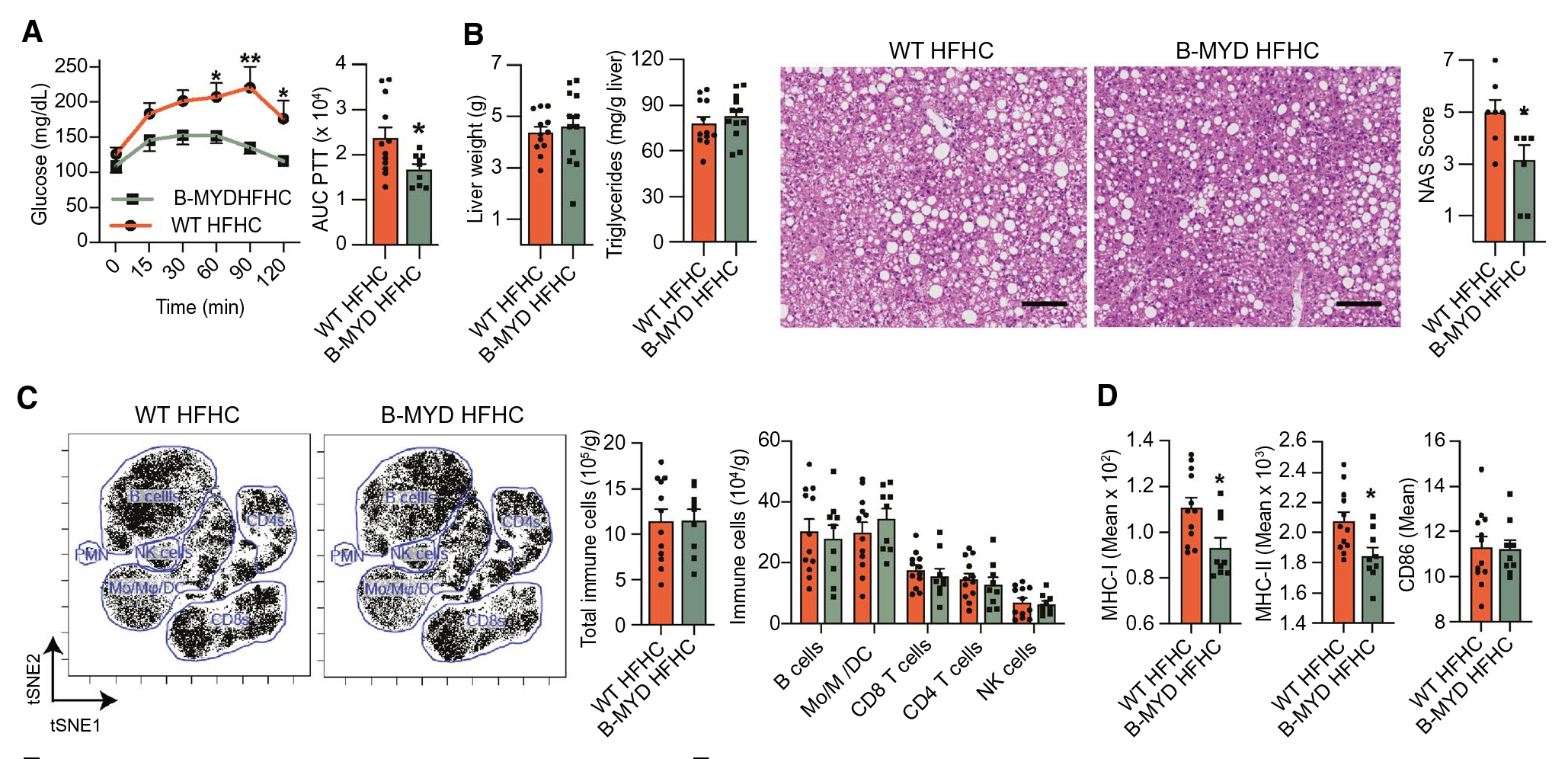
图4 MyD88介导NASH中B细胞的炎症功能
5. BCR刺激激活肝内B细胞
BCR与抗原结合产生的激活信号是B细胞活化的第一信号,接下来作者探究了在NASH过程中肝内B细胞的激活是否与BCR信号有关,因BCR信号传导在Nur77基因的控制下诱导绿色荧光蛋白 (GFP) 表达,作者给Nur77-GFP小鼠喂食NCD或HFHC,结果发现HFHC Nur77-GFP小鼠的GFP+肝内B细胞的频率和数量显著增加,表明在NASH期间的激活涉及肝脏中的BCR信号。该结果表明,NASH中,B细胞的活化受到BCR信号刺激。
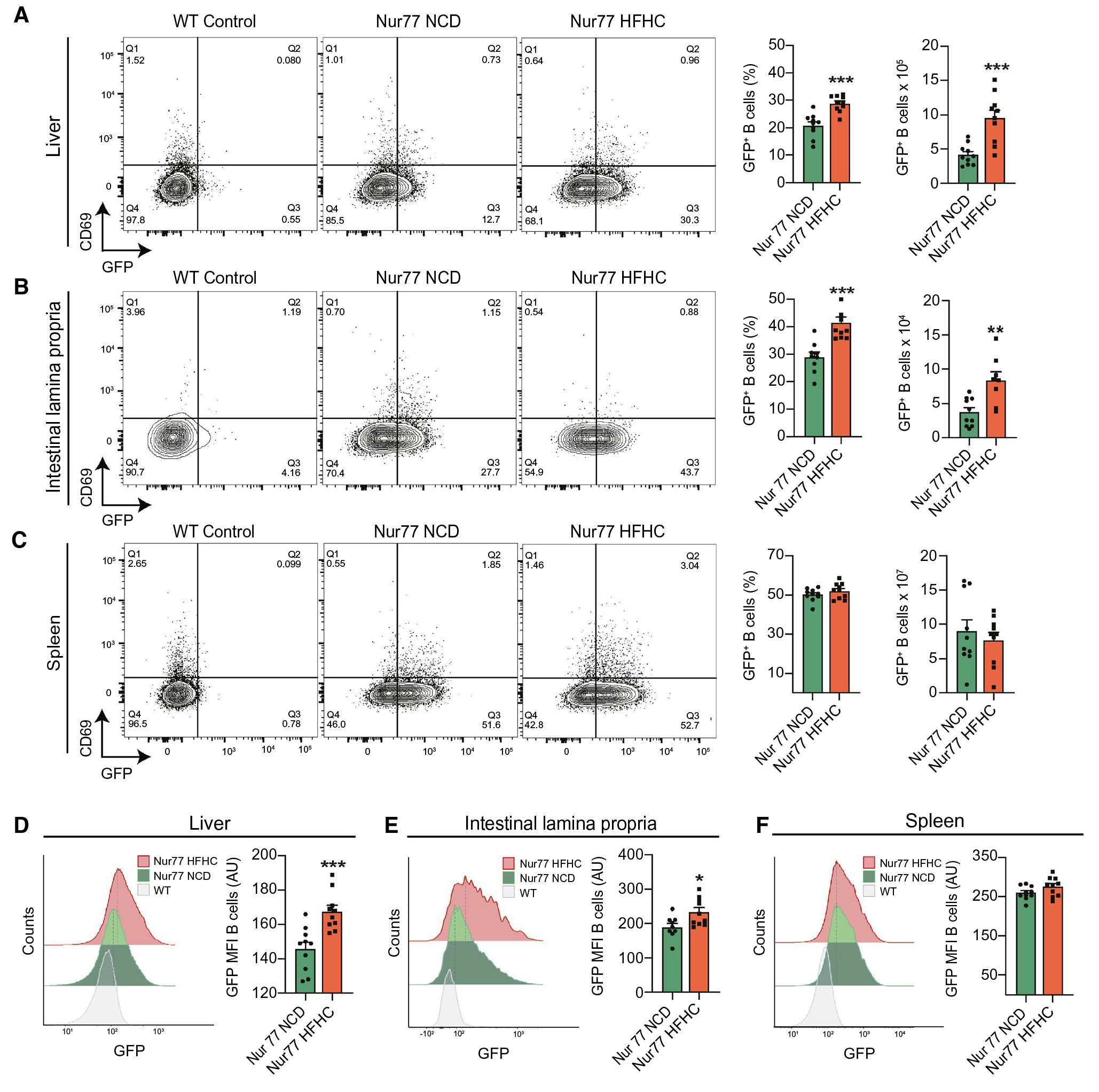
图5 B细胞通过BCR被激活
6. 肠源性微生物因子促进肝内B细胞活化
为了研究NAFLD相关菌群失调产生的细菌产物是否促进肝内B细胞活化,作者构建了FMT小鼠模型,与健康FMT小鼠相比,NAFLD FMT小鼠表现出拟杆菌门和变形菌门丰度增加,该结果与NAFLD供体的菌群比例具有高度相似性。且NAFLD FMT小鼠NAS评分略有增加,肝内B细胞数量增加,抗原呈递和共刺激分子的表达增加,纤维化轻微增加。这些数据表明,肠道菌群中与NAFLD相关的变化足以诱导肝脏中B细胞的积累和活化,同时将肝脏病理学的各个方面从人类供体传递给受体小鼠。
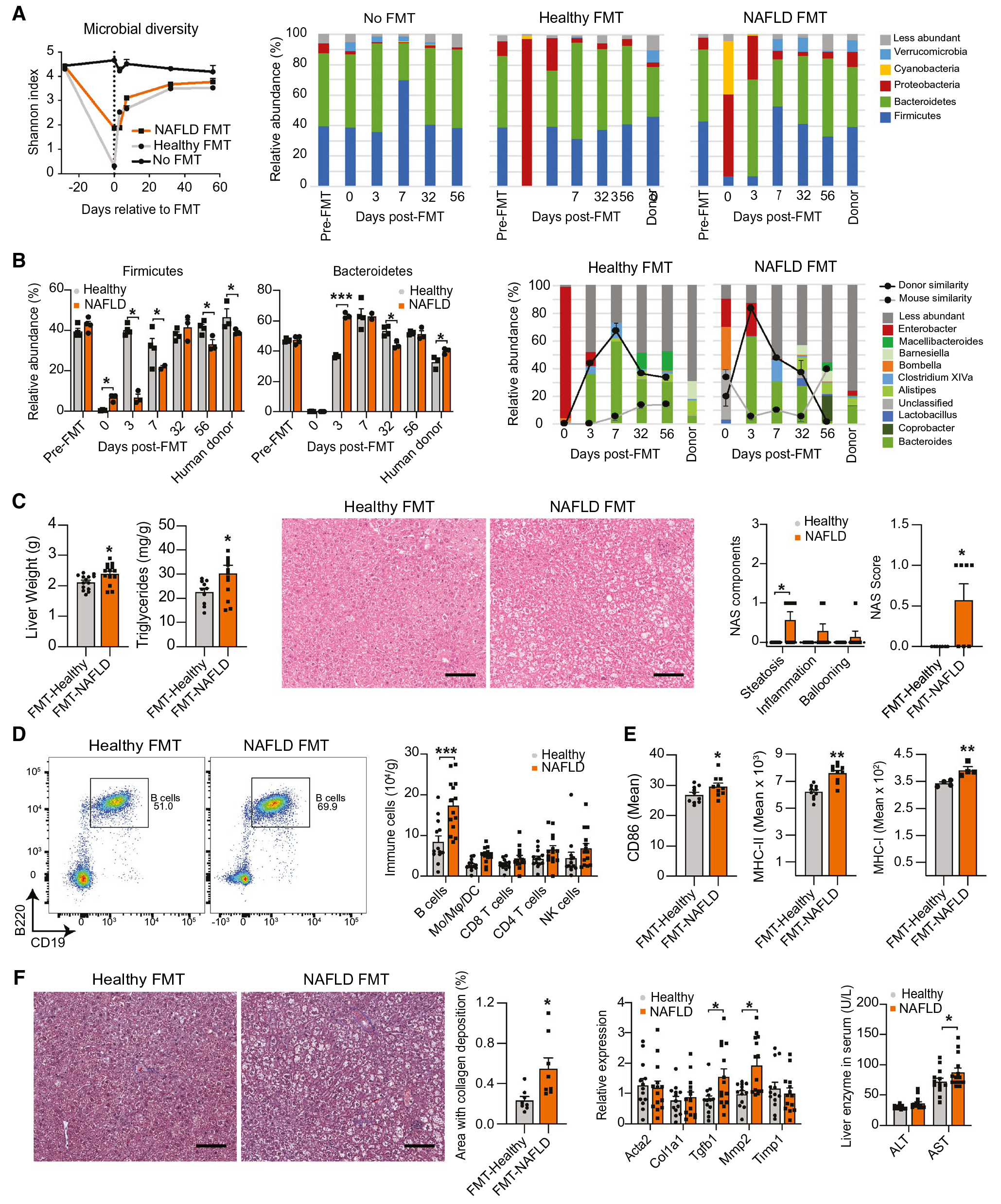
图6 肠源性微生物因子促进肝内B细胞活化
结论
