多形胶质母细胞瘤(GBM)是成人最常见和最致命的原发性脑肿瘤,虽可采用手术切除、放射治疗和化疗等治疗方式,但中位生存期仅15个月。鉴于肿瘤的不良结果和流行程度,对创新疗法的需求仍然是临床迫切需要解决的问题。当前靶向肿瘤代谢尚未成为临床用于GBM治疗的方法,而且在靶向代谢治疗方面,对Warburg效应的认同导致人们更多地关注靶向葡萄糖代谢来阻止肿瘤进展。然而除了葡萄糖外,其他代谢途径是如何满足GBM不断增长的复制和进展需求的尚不清楚。伊利诺伊大学医学院Kiran K. Velpula团队于《Theranostics》发表前瞻性综述,旨在探讨糖酵解、脂肪酸氧化、尿素循环、谷氨酸-谷氨酰胺循环和一碳代谢的代谢物如何转向能量产生途径,以满足GBM的高能量需求,为推动靶向肿瘤代谢的临床诊疗研究奠定基础。
糖酵解
即使在有氧的情况下癌细胞仍利用大量的葡萄糖排泄大量乳酸被称为Warburg效应,它是最早被发现的癌症异常代谢途径之一,许多癌症(如GBM)恶性细胞内的线粒体功能障碍导致其对厌氧代谢的异常依赖,以满足能量代谢需求,肿瘤微环境决定了细胞是主要依赖糖酵解还是氧化磷酸化,GBM对糖酵解的依赖可能主要基于ATP的产生。
肿瘤微环境中高度依赖糖酵解,一些旨在逆转Warburg效应的治疗方法正在被开发,以防止GBM的生长和增殖。Poteet等人的研究证明亚甲基蓝通过接受线粒体复合物I和 NADH的电子并将其转移到细胞色素C,使丙酮酸进入柠檬酸循环,进而逆转GBM中的Warburg效应。当与替莫唑胺(TMZ)联合使用时,亚甲基蓝作为添加剂分别对致敏和耐药TMZ-GBM细胞系U87和T98G发挥作用;另一项研究中Velpula等人报道,以丙酮酸脱氢酶激酶(PDK1)为靶点,通过降低GBM内缺氧诱导因子(HIF-1)的表达,逆转Warburg效应。GBM的低氧核心稳定HIF-1的表达,从而诱导PDK1和表皮生长因子受体(EGFR)的活化,通过靶向PDK1, GBM细胞的代谢从主要的糖酵解转向氧化磷酸化,导致U251和5310细胞系内的凋亡、抗增殖作用和降低侵袭能力。
总之,糖酵解是最原始的能量途径,但对复杂的癌症(如GBM)最有利。糖酵解通过复杂的相互作用调控,涉及葡萄糖转运蛋白1(GLUT1),己糖激酶2 (HK2),丙酮酸激酶M2亚型(PKM2),乳酸脱氢酶A (LDHA)和HIF-1肿瘤微环境和线粒体基因,当前文献已经证明靶向这些蛋白质中的任何一种均可逆转GBM中的Warburg效应,从而诱导细胞凋亡和活性氧敏感性,糖酵解是GBM的重要治疗靶标。需要进一步研究来阐明和优化辅助TMZ的抗糖酵解疗法,包括GBM亚型对糖酵解的依赖性及其他代谢机制的偏好。总之,糖酵解在GBM能量代谢中的意义不仅限于ATP的初始途径,它充当各种反应的中心枢纽,其中间体可能会被分流至其他机制,其他途径的代谢物也可能进入其中。
脂肪酸氧化
脂肪酸氧化涉及通过去除两个碳乙酰基-CoA亚基并生成一个NADH和一个FADH来缩短酰基-CoA分子循环,重复这种缩短酰基辅酶A的过程,直到酰基辅酶A完全分解或直至丙酰基辅酶A的三碳结构为止,该结构可以转化为琥珀酰基辅酶A并进一步用于TCA循环。NADH和FADH2的单位有助于线粒体中的电子传递链,通过氧化磷酸化将其消耗以进一步产生ATP。如图1所示,脂肪酸氧化是一种重要的能量来源,每单位质量产生的ATP比糖原分解多6倍,且脂肪酸氧化的活性在GBM中已被证明有助于有氧呼吸,参与脂肪酸氧化的酶,特别是肉碱棕榈酰基转移酶和长链酰基辅酶A脱氢酶,已被发现在人脑胶质瘤组织中上调。
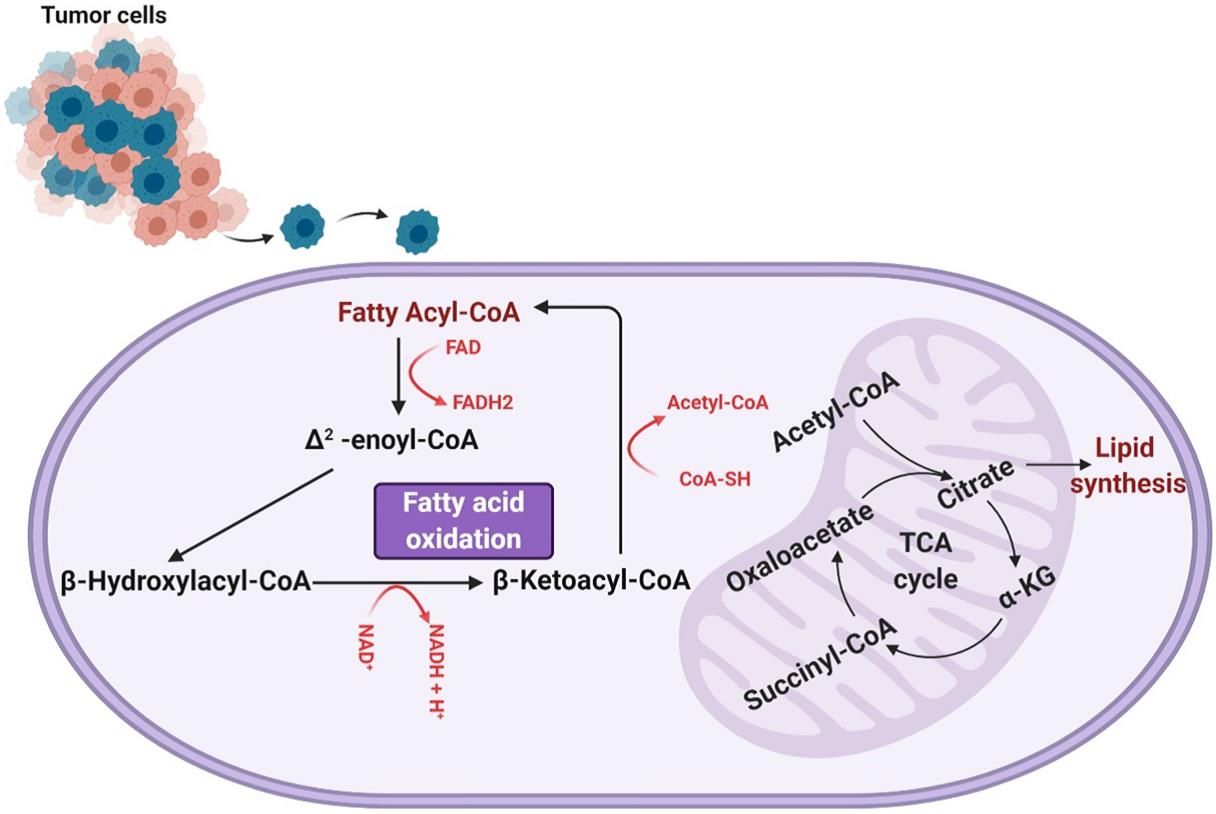
图1. 脂肪酸β氧化
Lin等人明确了线粒体中有氧呼吸依赖脂肪酸的程度,利用海马分析仪测量耗氧率(一种测量细胞中氧依赖性代谢活性的方法),用亚油酸和依托莫司(抑制脂肪酸氧化)处理过的hGBM细胞和用FCCP和抗霉素A(诱导最大的氧化呼吸)处理的hGBM的耗氧量进行比较,结果表明近80%的氧气呼吸依赖于脂肪酸氧化。Juraszek和Fink等人证实了神经胶质瘤对脂肪酸氧化的依赖性,测量了SLC22A5 / OCTN2(一种将肉碱传递到细胞中的有机转运蛋白)的表达,发现它在人类神经胶质瘤细胞中过表达。响应于脂肪酸氧化的抑制,人神经胶质瘤细胞的活力降低,凋亡增加,脂肪酸氧化对神经胶质瘤的能量生成有重要作用,它为我们理解神经胶质瘤如何破坏正常的能量生成以维持异常的生长和增殖提供了重要的研究途径。实验结果还表明脂肪酸氧化除作为一种直接的能量来源外,还限制了细胞内活性氧(ROS)水平,因为活性氧水平不受控制地增加可导致癌细胞死亡,有助于癌症患者生存。Pike等人分析了1mm CPT-1抑制剂依托莫司处理25分钟后细胞内ROS的水平,最终发现与对照组细胞相比,依托莫司处理的细胞ROS水平升高(超氧化物荧光水平升高)。
尿素循环
尿素循环通常被认为是含氮废物代谢的内在机制,氨通常作为体内平衡的有毒副产物积累,尿素循环在其转化为尿素的过程和癌症代谢中起着不可或缺的作用。精氨酸被认为是癌细胞中许多代谢功能上调的底物。在生理条件下容易获得,许多实体瘤(如GBM)显示出精氨酸的利用率升高,维持胞内足够的精氨酸来源依赖于从细胞外环境的摄取。有趣的是,GBM的某些表型显示内源性精氨酸合成能力下降,通过沉默限速酶精氨酸琥珀酸合成酶1(ASS1)可有效抑制尿素循环,因而这些癌症表现为营养缺陷,进一步促进了其对细胞外精氨酸的依赖性。
ASS1沉默在上述癌症表型中具有优势,抑制ASS1被认为是将上游底物转移到其他代谢途径的有效机制。Rabinovich等人假设在常氧条件下ASS1沉默可促进细胞增殖所必需的合成代谢功能,由于天冬氨酸同时作为精氨酸和嘧啶合成的底物,ASS1的下调被认为使氨基酸转向从头合成嘧啶,并在ASS1沉默癌细胞中增加CAD(磷酸合成酶2、天冬氨酸转氨甲酰酶和二氢乳清酸酶)活性进一步证明,CAD作为一种三功能酶主要调控嘧啶从头合成的起始,表明CAD抑制对ASS1沉默细胞增殖的抑制作用。
此外,有许多其他的调控途径能够调控ASS1的表达,如HIF1α是ASS1的潜在调控因子,HIF1α激活能够通过翻译沉默抑制ASS1,HIF1α作为对日益增加的酸性/低氧环境的响应机制,利用ASS1抑制来维持pH稳态。有趣的是,低氧和低细胞外pH的存在似乎都独立和协同地增强了ASS1的沉默。通过沉默ASS1,随后细胞pH缓冲的增加也被报道为细胞内尿素、谷氨酰胺和谷胱甘肽浓度的增加,图2描述了发生在ASS1沉默的GBM中的代谢分流。GBM ASS1阴性表型与临床预后不良相关,ASS1沉默癌细胞所显示的精氨酸缺乏症已经证明了对精氨酸剥夺疗法的敏感性,同时其在急性骨髓性白血病(AML)中的作用也已得到充分证明。
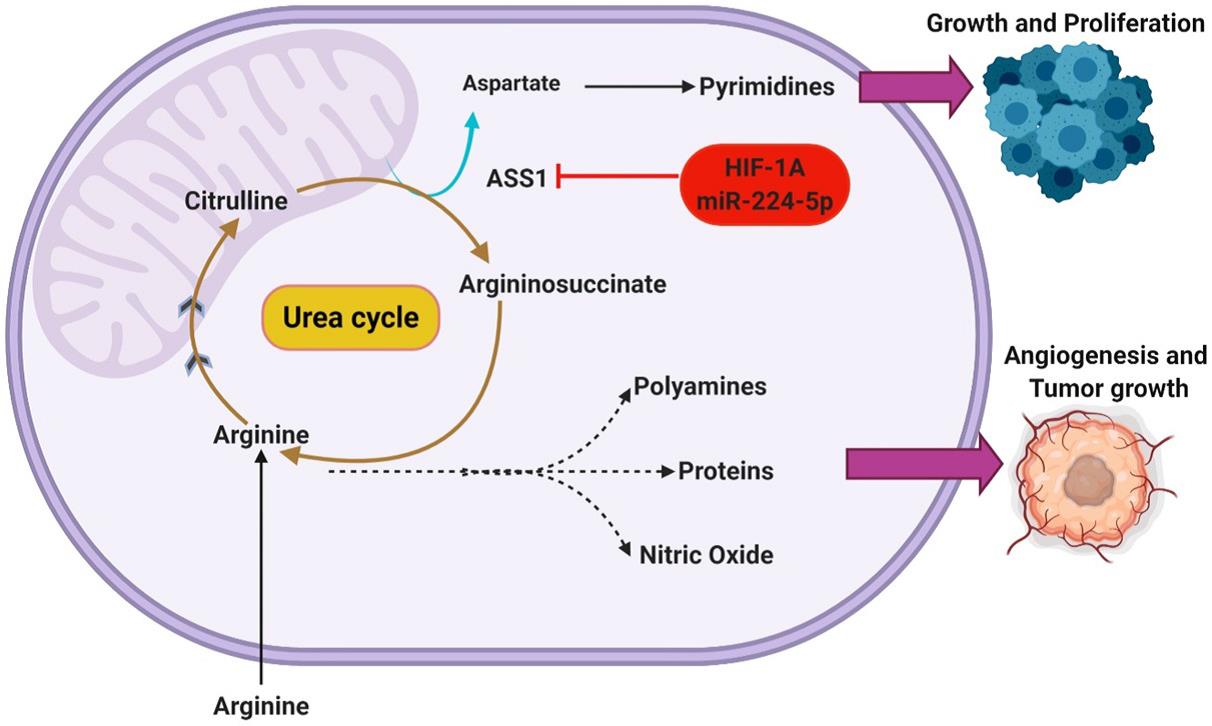
图2. 抑制尿素循环
谷氨酸-谷氨酰胺循环
GBM等许多恶性肿瘤的标志是极高的谷氨酰胺(Gln)消耗率。在非增殖细胞中,谷氨酰胺是一种非必需氨基酸,主要用于掺入蛋白质或作为氨基酸和核苷酸生物合成的氮供体。但在高度增殖的细胞中,谷氨酰胺的消耗量已超过蛋白质合成所需量的十倍之多,而且培养的肿瘤细胞所需谷氨酰胺的量至少是其他氨基酸的十倍以上。它在某些癌症中应用非常广泛,尽管谷氨酰胺是一种非必需氨基酸但肿瘤生长仍需外源性摄入,这种现象被称为谷氨酰胺成瘾。恶性GBM是谷氨酰胺摄取增加的癌症亚型之一,Sidoryk等人观察到GBM样品中谷氨酰胺N转运蛋白3(SNAT3)和丙氨酸/丝氨酸/半胱氨酸转运蛋白2(ASCT2)的mRNA转录表达显著增加。在恶性细胞中,过量谷氨酰胺摄取和分解代谢有三个主要目的:在TCA循环中通过动脉粥样硬化生成NADPH,支持谷氨酸的产量显著增加,并通过LAT1反转运蛋白促进必需氨基酸(EAA)的摄取。
如图3所示,谷氨酰胺以α-KG的形式通过谷氨酰胺酶(GA)和丙氨酸转氨酶(ALT)的两步转运进入TCA循环,它最终转化为苹果酸,并通过苹果酸酶(ME)的活性转化为丙酮酸,从而产生NADPH,丙酮酸通过乳酸脱氢酶最终转化为乳酸,乳酸被排出体外。DeBerardinis等发现SF188胶质母细胞瘤细胞系中超过60%的谷氨酰胺最终转化为乳酸,表明该通路在胶质母细胞瘤中具有高活性,所得到的NADPH为脂肪酸和核苷酸合成提供能量。此外,发现大多数细胞内OAA都来自谷氨酰胺而非葡萄糖,这表明谷氨酰胺摄取对于为持续的柠檬酸合酶活性提供OAA是必需的,该机制在IDH突变型GBM中尤为重要,因为谷氨酰胺代谢补充了TCA循环中间体,否则该中间体将不会以高浓度存在。
多项研究表明,通过胱氨酸-谷氨酸逆向转运体释放谷氨酸的兴奋毒性促进了恶性GBMs的生长,导致附近神经元中N-甲基D-天冬氨酸(NMDA)受体的延长激活触发细胞内Ca2+内流,从而诱导细胞凋亡。肿瘤周围细胞的破坏被认为促进肿瘤向周围组织的侵袭并为恶性细胞提供营养。与正常星形胶质细胞相比,GBM细胞的谷氨酸摄取明显降低,C6胶质瘤细胞系显示谷氨酸-天冬氨酸转运蛋白(GLAST),谷氨酸转运蛋白1(GLT1)及兴奋性氨基酸载体1(EAAC1)丢失。谷氨酸摄取率的降低导致肿瘤细胞内Ca2+内流降低,有效地保护细胞免于兴奋毒性。事实上,Ca2+内流通过AMPA受体导致AKT磷酸化,促进恶性细胞的生长和增殖。在GBM中谷氨酰胺摄取速率的增加有助于内源性谷氨酸的产生。由于GBM非常依赖于谷氨酰胺的摄取,因此谷氨酰胺代谢或谷氨酸信号的改变可以成为受关注的治疗靶标。NMDA拮抗剂MK801对C6胶质瘤细胞的治疗导致分泌谷氨酸的肿瘤生长明显降低,针对癌细胞中谷氨酰胺贮库的药理干预措施的研究是一个非常有潜力的方向。
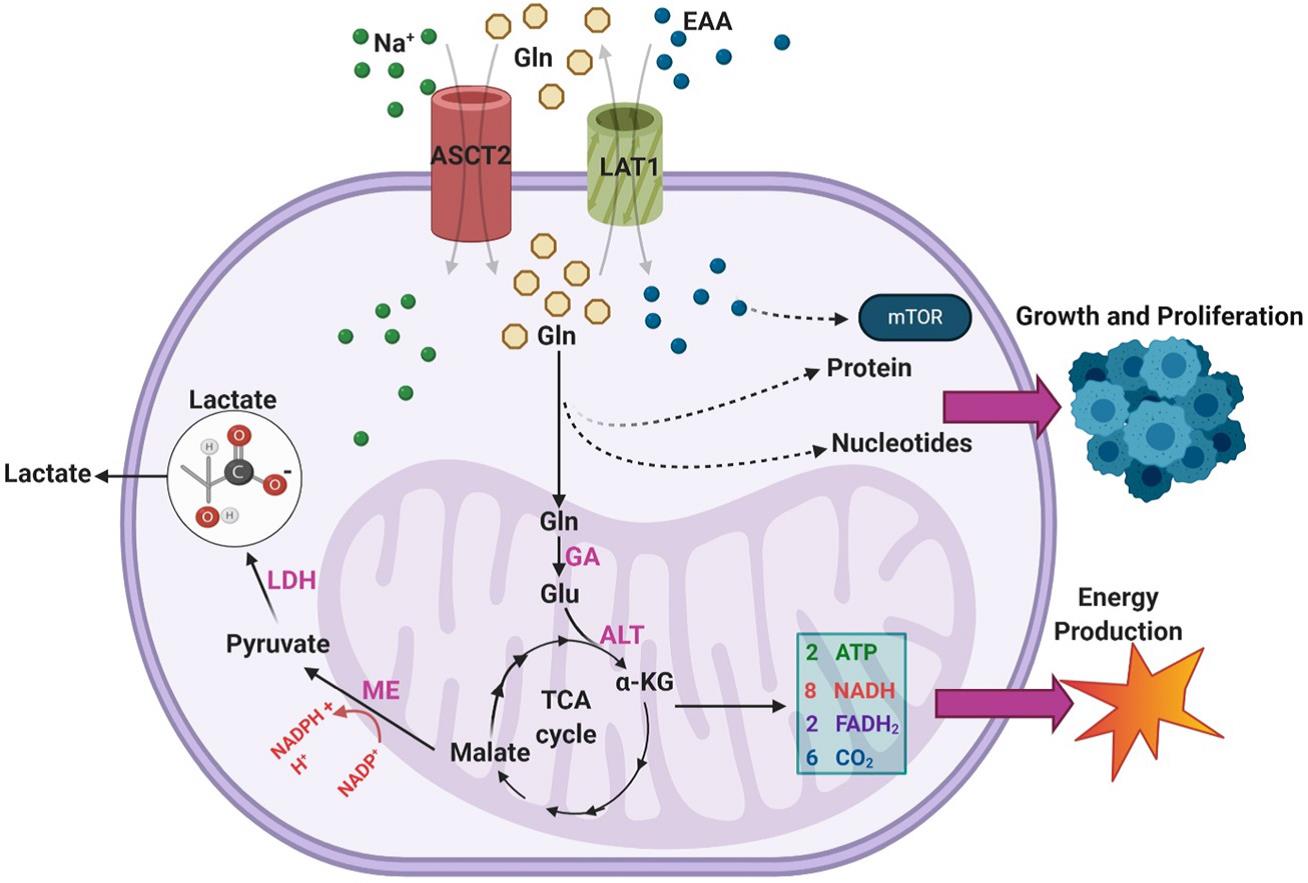
图3. GBMs利用外源谷氨酰胺(Gln)
一碳代谢
一碳代谢(OCM)是胶质瘤维持生物合成活性的另一个途径,OCM是发生在线粒体细胞质中的一组反应,线粒体包含在叶酸和蛋氨酸循环中,并提供甲基基团,以便生成磷脂、氨基酸和DNA等一系列代谢物。在叶酸循环中,叶酸通过脱氢叶酸还原酶被还原为四氢叶酸(THF),此时THF可以从丝氨酸和甘氨酸等来源获得甲基,从而生成甲基THF,甲基THF作为一碳供体,是一种涉及许多过程的有效辅助因子,如通过蛋氨酸循环生成S-腺苷甲硫氨酸(SAM)。在蛋氨酸循环中,甲基-THF向高半胱氨酸提供一个碳原子单元以将其转化为蛋氨酸,该反应由蛋氨酸合酶催化。然后蛋氨酸腺苷基转移酶进一步催化蛋氨酸,从而产生SAM(通过一系列反应可再生高半胱氨酸从而完成循环),SAM是许多甲基化反应的辅助因子,因此对于脂质、DNA和蛋白质的产生至关重要。
作为神经胶质瘤代谢的重要组成部分,由一碳代谢组成的叶酸和蛋氨酸循环是调节肿瘤代谢的潜在靶点。Xu等研究发现miR-940直接靶向并抑制叶酸一碳代谢的关键酶--亚甲基四氢叶酸脱氢酶(MTHFD2),同时观察到miR-940的过表达不仅降低了细胞样品中的叶酸代谢,而且还促进了细胞凋亡并抑制了胶质瘤细胞的侵袭,因此它成为靶向肿瘤生长的新手段。关于蛋氨酸周期调节作为抑制神经胶质瘤代谢的研究还很少,但Palanichami等人证明了向GBM细胞补充外源蛋氨酸可以促进和维持该细胞生长。因此,抑制胶质瘤内源性蛋氨酸含量仍是一种潜在有效的治疗途径。
GBM代谢靶点

表1. GBM代谢靶点
小结
本综述探讨了GBM生长和肿瘤发生的相关基础代谢机制,恶性GBMs利用各种非常规分子维持生长,使得肿瘤比健康的中枢神经系统细胞拥有更大的能量储备,后者几乎完全依赖葡萄糖来产生能量。除了上调糖酵解,GBMs已经被证明利用脂肪酸、谷氨酰胺、叶酸和蛋氨酸(及其甲基化衍生物)、尿素循环代谢物和自噬来满足其高ATP需求。以改变肿瘤代谢为目的的新的治疗靶点不断被发现,此外,膳食调整在GBM治疗中的效用已备受关注,如生酮饮食(KD)已被理论证明是有益的,可见饮食调整和代谢靶向疗法值得深入研究,靶向肿瘤代谢的治疗可有效减少GBM的体外生长。因此需要进一步的体内研究来充分阐明代谢靶向肿瘤治疗的作用及不良反应。
绘谱帮你测
能量代谢的改变机制一直是恶性肿瘤细胞研究的热点,围绕糖酵解途径,多种脂肪酸、氨基酸及其衍生物等代谢产物在肿瘤细胞内外发生显著改变。针对能量代谢途径的干预很可能对未来多种肿瘤的诊断与治疗产生影响。但其中大部分机制研究仍处于起步阶段,监测代谢物的变化可为肿瘤的代谢研究提供最直接的证据。本文所涉及的糖酵解、脂肪酸、谷氨酰胺、叶酸和蛋氨酸、尿素循环代谢物等相关代谢物检测,麦特绘谱均可提供全套解决方案!欢迎联系获取详细资料。
参考文献
John L. Caniglia, Anvesh Jalasutram, Kiran K. Velpula, et al. Beyond glucose: alternative sources of energy in glioblastoma. Theranostics, 2021; 11(5): 2048-2057. doi:10.7150/thno.53506.
原文阅读,请长按识别下方二维码

精彩推荐
4. Cell Metabolism | 氨基酸如何支持免疫(下)
5. Physiol Rev | 脂肪酸在健康与疾病中的作用(上)
6. Physiol Rev | 脂肪酸受体在健康与疾病中的作用(下)
7. Nature | 衰老个体中甲基丙二酸的积累可促进肿瘤进展
8. Nature Cell Bology | 天冬酰胺促进T细胞活化和抗肿瘤效应
9. Nature Communications | 谷氨酰胺氮代谢转变有助于癌症恶性进展


