单细胞技术哪家强,翌圣生物来帮忙。
一
单细胞技术介绍
单细胞测序技术,简单来说,就是在单个细胞水平上,对基因组、转录组及表观基因组水平进行测序分析的技术。传统的测序,是在多细胞基础上进行的,实际上得到的是一堆细胞中信号的均值,丢失了细胞异质性(细胞之间的差异)的信息。而单细胞测序技术能够检出混杂样品测序所无法得到的异质性信息,从而很好的解决了这一问题。
二
单细胞技术类型
单细胞技术类型很多,有单细胞转录组、单细胞基因组、单细胞表观组(单细胞ATAC、单细胞CUT&Tag、单细胞甲基化、单细胞Hi-C等)、单细胞蛋白组、单细胞代谢组等,各种技术不断迭代,检测灵敏度也不断提升。
在众多细胞技术中,应用最广泛的当属单细胞转录组了。
单细胞转录组也分为低通量的smart-seq1/2/3和高通量的微流控和微孔板等研究。
今天我们要介绍的主角是Smart-seq2
三
单细胞技术类型
·
Smart-seq技术于2012年由Ramsköld团队发表;
·
Smart-Seq2技术于2013年及2014年由Picelli团队改进并发表;
·
Smart-seq3技术则于2020年由瑞典卡罗林斯卡学院的Rickard团队进一步改进并发表。
·
虽然Smart-seq技术也迭代了多个版本,但是迄今为止,Smart-Seq2是使用最多且被广泛认为更稳定的技术类型,也是国内市场众多科技服务公司推崇的技术之一。
3.1
Smart-seq2技术原理
Smart-seq2关键技术原理有:
01
MMLVRT
使用的MMLV具有链置换活性和末端转移酶活性。其在逆转录到达mRNA 5’端末端时,会在新合成的cDNA的3’末端多出几个C碱基;
02
TSO引物序列
TSO引物的5’端含有1个通用引物序列,而在其3’端,有两个核糖鸟苷(rG)和一个锁核苷酸(LNA)修饰的鸟苷(G),可以促进模板转换,进而扩增出完整的cDNA序列;
03 甜菜碱、海藻糖的添加
某些物种RNA中有发夹结构、环形结构等二级结构容易形成空间位阻影响逆转录酶结合,添加甜菜碱和海藻糖能在一定程度上增加酶的热稳定性,同时破坏RNA的空间位阻。同时,甜菜碱和Mg2+同时存在,能在一定程度上提高cDNA产量。

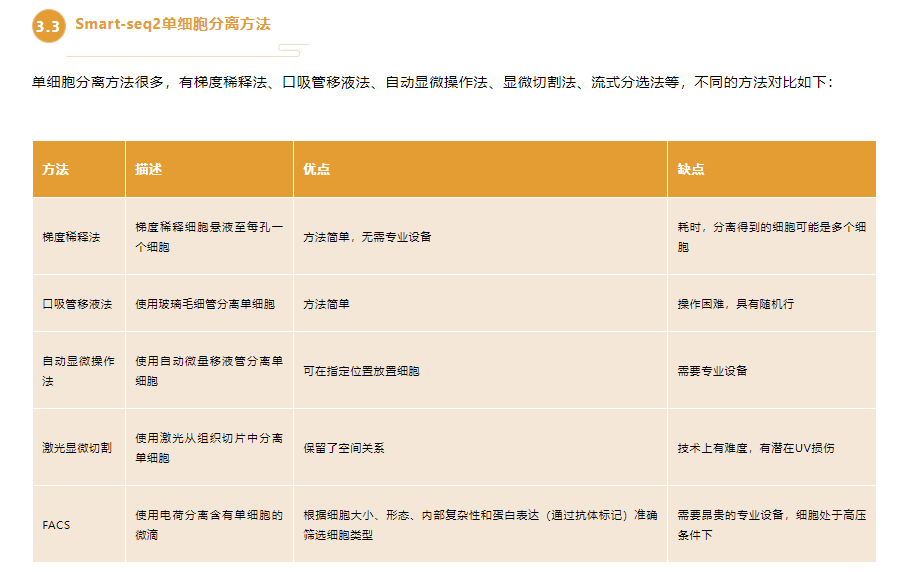
单细胞分离方法很多,有梯度稀释法、口吸管移液法、自动显微操作法、显微切割法、流式分选法等,不同的方法对比如下:
|
方法 |
描述 |
优点 |
缺点 |
|
梯度稀释法 |
梯度稀释细胞悬液至每孔一个细胞 |
方法简单,无需专业设备 |
耗时,分离得到的细胞可能是多个细胞 |
|
口吸管移液法 |
使用玻璃毛细管分离单细胞 |
方法简单 |
操作困难,具有随机行 |
|
自动显微操作法 |
使用自动微量移液管分离单细胞 |
可在指定位置放置细胞 |
需要专业设备 |
|
激光显微切割 |
使用激光从组织切片中分离单细胞 |
保留了空间关系 |
技术上有难度,有潜在UV损伤 |
|
FACS |
使用电荷分离含有单细胞的微滴 |
根据细胞大小、形态、内部复杂性和蛋白表达(通过抗体标记)准确筛选细胞类型 |
需要昂贵的专业设备,细胞处于高压条件下 |
3.4
Smart-seq2技术与其他单细胞技术对比
单细胞技术除了Smart-seq、Smart-seq2和Smart-seq3之外,还有CEL-seq2/C1、Drop-seq、MARS-seq、SCRBseq。文章Ziegenhain C, Vieth B, Parekh S, et al. Comparative Analysis of Single-Cell RNA Sequencing Methods. Mol Cell. 2017;65(4):631-643.e4. doi:10.1016/j.molcel.2017.01.023从不同角度来对单细胞技术进行评估,综合来看,Smart-seq2更胜一筹。

六种测序方法都有比较好的测序质量,均超过 50% 的数据成功被 mapping到。另外,可以明显发现基于全长测序方案的 Smart-seq 较 UMI,外显子区域的 reads 更多,其中 smart-seq2 有 48% 的 reads 比对到外显子区域(如下图)。这表明 Smart-seq2(48% reads 比对到外显子)和 Smart-seq(30% reads 比对到外显子)较 UMI 方案(均低于 15% reads 比对到外显子)有更好的测序质量。
基因检测效率对比
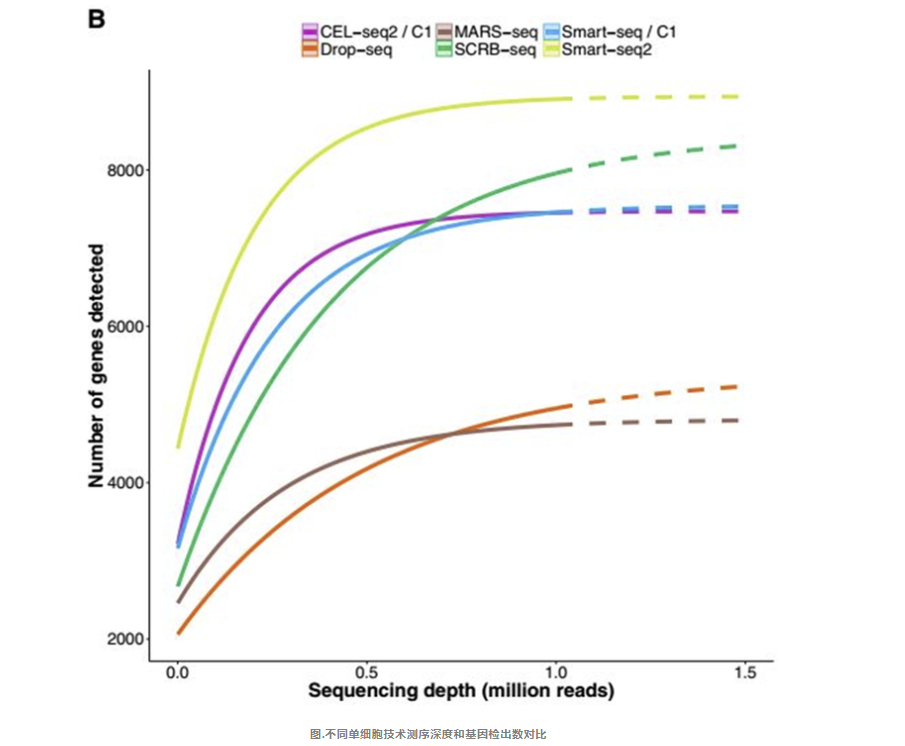
采用抽样的饱和度分析对测序深度进行评估,当测序深度达到 100 万reads时,这六种测序方法均可达到饱和,但明显 Smart-seq2 具有更好的基因检测效率。
单个细胞进行实验时的敏感度对比
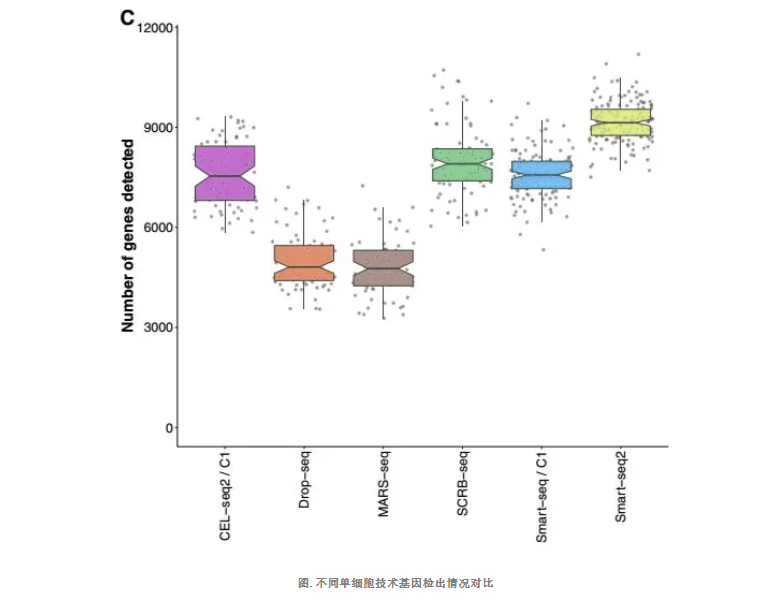
在相同的单个细胞进行单细胞建库,相同的测序深度下,检测单细胞中基因表达数量。结果发现,Smart-seq2 敏感度最好,达到中位数 9138/cell,而最低的是 Drop-seq 和 MARS-seq,分别约为 4811/cell 和 4763/cell。
多个细胞进行实验时的敏感度对比
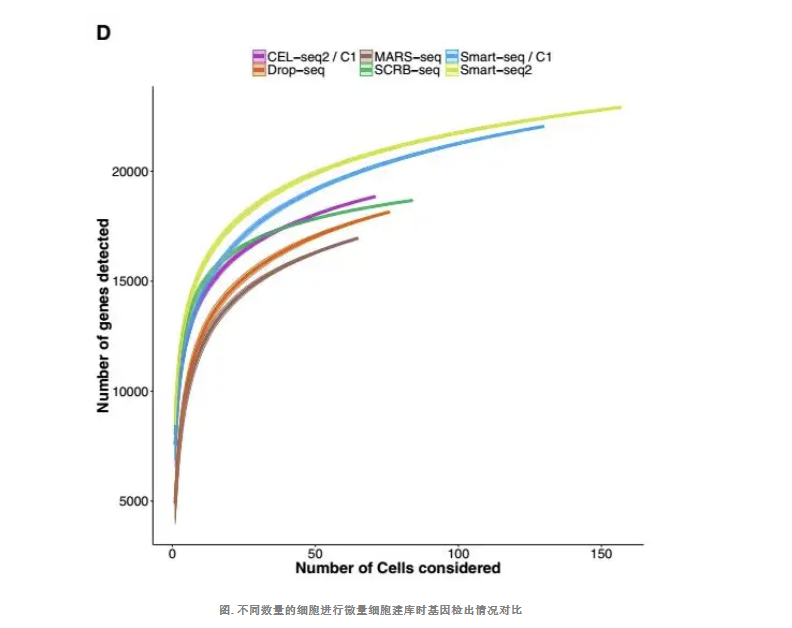
多个细胞建库后的reads合在一起进行生信分析,结果发现,Smart-seq2 仍然具有更多的基因被检测到,MARS-seq 仍然具有最少的基因被检测到,这与单细胞敏感度检测是一致的。
单细胞建库结果重复性对比
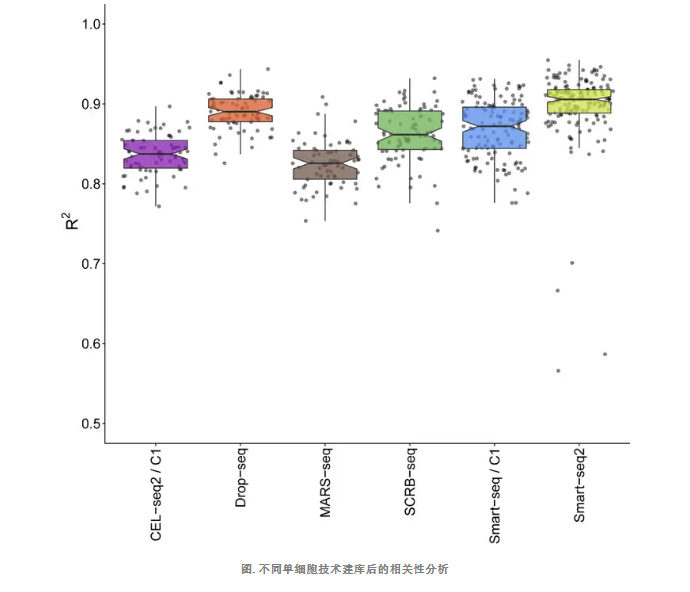
利用 92 个已知的外源 ERCC 转录本,进一步采用线性模型拟合了观测的表达值与已知浓度的相关系数(R2)。通过分析发现,这六种方法的相关系数都较高,都高于 0.80 的相关系数。这表明这六种方法的准确度都较好,但 Smart-seq2 的相关系数为 0.91,而 MARS-seq 相关系数为 0.83。
不同单细胞技术的Drop out对比
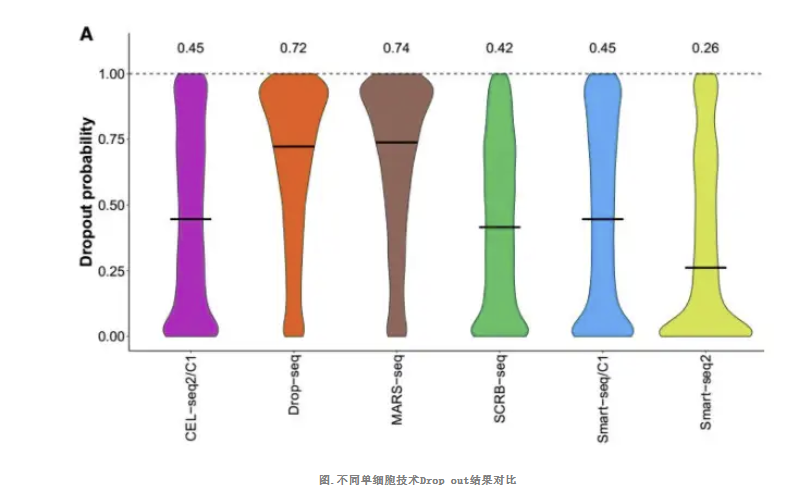
对至少 65 个单细胞分析中发现,13361 个基因在 25% 的细胞中至少被一种方法检测到表达,那么挑选这些基因进行分析,MARS-seq 具有最高的 drop out 中位概率(74%),而 Smart-seq2 最低(26%),此时说明 Smart-seq2 具有更好的敏感度,这与之前的敏感度也是对应的。
看了以上结果,是不是对Smart-seq2技术更心动了呢,如果你有需求,联系翌圣获取详情吧!
想了解更多建库细节,也联系翌圣吧!
四
产品推荐
|
产品名称 |
货号 |
规格 |
|
Hieff NGS® Single Cell/Low Input cDNA Synthesis & Amplification Module |
12500ES24/96 |
24 T/ 96 T |
|
Hieff NGS® Single Cell/Low Input RNA Library Prep Kit |
12502ES24/96 |
24 T/ 96 T |
|
Hieff NGS® Fast Tagment DNA Library Prep Kit for Illumina® (for 1 ng) |
13468ES24/96 |
24 T/ 96 T |
|
Hieff NGS® Tagment Index Kit for Illumina® |
12416ES24/96/97 |
24 ×2T/ |
|
Hieff NGS® 384 Dual Index Primer Kit for Illumina® ,Set 1/Set 2(96 种) |
12412ES02 12413ES02 |
96×2 T |
|
Hieff NGS® Stubby UDI Primer Kit for Illumina®(板式)(787种)
|
12327ES01/02 12328ES01/02 12329ES01/02 12330ES01/02 12331ES01/02 |
96×1 T/ |
|
Hieff NGS® Unique Dual Barcode Primer Kit for MGI® Set1/Set2/Set3/Set4(板式)(384种) |
13350ES01/02 13351ES01/02 13352ES01/02 13353ES01/02 |
96×1 T/ |
