Calcein AM,中文名钙黄绿素乙酰氧基甲酯,是一种可渗透进入细胞、常用于测定真核细胞活力或线粒体通透性转换孔(Mitochondrial Permeability Transition Pore, MPTP)的绿色荧光探针。Calcein AM近年来被广泛应用到细胞活性分析实验中。
Calcein AM (Calcein Acetoxymethyl Ester,中文名称为钙黄绿素AM或钙黄绿素乙酰氧基甲酯),是在Calcein (钙黄绿素)的基础上增加了乙酰氧基甲酯(AM)基团,加强了疏水性,因此能够轻易穿透活细胞膜。Calcein AM本身并无荧光,进入细胞后被细胞中内源性酯酶水解生成具有强负电荷的不能通透细胞膜的极性分子钙黄绿素(Calcein),从而被滞留在细胞内,而Calcein可发出强绿色荧光。与其它同类探针相比,由于Calcein AM的细胞毒性非常低,几乎不会影响细胞功能如细胞增殖或淋巴细胞的趋化性等,而且对pH值敏感性低,所以Calcein AM是目前染活细胞的最理想荧光探针之一。
由于死细胞缺乏酯酶,Calcein AM仅用于对活细胞的活力测试和短期标记,而核酸红色荧光染料碘化丙啶(Propidium Iodide, PI)由于不能穿透活细胞的细胞膜而只能染色细胞膜完整性被破坏的死细胞,所以Calcein AM常常与碘化丙啶(ST511)联合使用,对活细胞和死细胞同时进行双重荧光染色。
Calcein AM可以应用于大多数的哺乳动物细胞。有报道称Calcein AM也可以用于某些植物细胞如拟南芥(Arabidopsis)的根边缘样细胞(root border-like cells)及某些酵母如Pichia anomala和Saccharomyces cerevisiae。某些寄生虫如Leishmania由于细胞膜组分的原因,Calcein AM不能进入活细胞,但却可以进入凋亡早期的寄生虫细胞,从而与PI联用用于检测凋亡早期的寄生虫。由于真菌和细菌有细胞壁,会阻碍Calcein进入细胞,因此Calcein AM不适合用于真菌和细菌。
Calcein本身是一种金属络合指示剂,在生理pH条件下和Co2+、Ni2+、Cu2+、Fe3+和Mn2+等金属离子络合时,荧光信号会发生淬灭。Calcein AM及其水解产物Calcein的分子结构式参考图1。
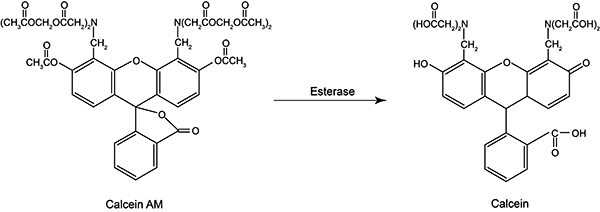
图1. Calcein AM及其水解产物Calcein的分子结构式。
Calcein AM分子式为C46H46N2O23,分子量为994.86,CAS号为148504-34-1。水解产物Calcein的最大激发光波长为494nm,最大发射光波长为514nm。Calcein的激发光谱和发射光谱参考图2。
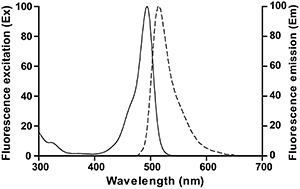
图2. Calcein的激发光谱和发射光谱。
本Calcein AM纯度高,>95.5%,溶解在无水DMSO中,浓度为2mM。Calcein AM的常用终浓度为0.1-5μM,为得到比较理想的结果,请根据细胞类型和实验实际情况对Calcein的最终浓度进行适当调整。
按Calcein AM最终工作浓度为0.1-5μM计算,本产品2mM×0.1ml包装可以配制40-2000ml的染色工作液,2mM×0.5ml包装可以配制0.2-10L的染色工作液。
包装清单:
| 产品编号 | 产品名称 | 包装 |
| C2012-0.1ml | Calcein AM (钙黄绿素AM) | 2mM×0.1ml |
| C2012-0.5ml | Calcein AM (钙黄绿素AM) | 2mM×0.5ml |
| - | 说明书 | 1份 |
保存条件:
-20℃避光保存,一年有效。
注意事项:
荧光染料均存在淬灭问题,请尽量注意避光,以减缓荧光淬灭。
Calcein AM在潮湿环境中容易分解,并避免反复冻融,收到产品后建议分装并-20℃密封保存。
由于Calcein AM在PBS等水溶液中不稳定,配制成工作液后需尽快使用。
培养液中的血清和酚红对Calcein AM的染色有一定的影响,建议在加入Calcein AM工作液前充分洗涤细胞。
Calcein AM标记的细胞,荧光均匀,而且对短期细胞迁移示踪效果非常好,但荧光的持续时间与细胞类型、培养条件等因素相关,一般在几小时之内,而且有时也会被某些类型细胞迅速外排。如果需要长时间标记细胞,请使用CFDA SE (C1031)等荧光探针。
本产品仅限于专业人员的科学研究用,不得用于临床诊断或治疗,不得用于食品或药品,不得存放于普通住宅内。
为了您的安全和健康,请穿实验服并戴一次性手套操作。
使用说明:
1.Calcein AM染色工作液的配制:
用合适的缓冲液,如无血清培养液、HBSS (C0218)或PBS (C0221A/C0221D)稀释2mM的本产品,配制成浓度为0.1-5µM的Calcein AM染色工作液。
注:Calcein AM的最终浓度建议根据细胞类型和实验实际情况进行适当调整。
2.悬浮细胞的荧光显微镜检测或荧光酶标仪检测:
a.细胞按实验设计进行一定处理后,计数。取适当细胞250×g室温离心5min,弃上清,加入适当体积的Calcein AM染色工作液使细胞密度约为1×106/ml。
b.37℃孵育细胞30-45min,不同的细胞最佳孵育时间不同。可以考虑以30min作为初始孵育时间,根据具体的实验情况进行适当优化得到更加理想的检测效果。
c.孵育结束后,250×g离心5min,吸除上清液,缓慢加入37℃预热的培养液重悬细胞。
d.重复步骤c两次或以上以充分洗涤去除残留的染色液。
e.更换新鲜的37℃预热的培养液,37℃再避光孵育30分钟,以保证细胞内酯酶充分水解Calcein AM以生成有绿色荧光的Calcein。
f.250×g室温离心5min,吸除大部分培养液,用剩余培养液将细胞重悬后涂片,在荧光显微镜下观察或荧光酶标仪检测。Calcein的最大激发光波长为494nm,最大发射光波长为514nm。如有需要,也可进行进一步进行其它荧光的复染,例如使用Annexin V-PE细胞凋亡检测试剂盒(C1065)或Propidium Iodide/碘化丙啶(ST511)检测细胞凋亡、Mito-Tracker Red CMXRos (C1049)检测线粒体活力、Hoechst 33342活细胞染色液(C1027/C1028/C1029)染色细胞核等。注意整个过程均需避光操作。
3.贴壁细胞的荧光显微镜检测或荧光酶标仪检测:
a.将细胞接种于培养皿、多孔细胞培养板或者细胞爬片上,按实验设计对细胞进行一定处理。
b.吸除培养液,用PBS清洗细胞1-2遍。
c.加入适当体积的Calcein AM染色工作液,轻轻晃动使染料均匀覆盖所有细胞。一般96孔板每孔体积为100μl,24孔板每孔体积为250μl,12孔板每孔体积为500μl,6孔板每孔体积为1ml。
d.37℃避光孵育30-45min,不同的细胞最佳孵育时间有所不同。以30min作为初始孵育时间,根据所用细胞对孵育时间进行适当优化以得到更加理想的染色效果。
e.孵育结束后,更换成新鲜的37℃预热的培养液,37℃再避光孵育30min,以保证细胞内酯酶充分水解Calcein AM以生成有绿色荧光的Calcein。
f.吸除培养液,用PBS清洗2-3次,然后加入无血清细胞培养液后即可在荧光显微镜下观察或荧光酶标仪检测。Calcein的最大激发光波长为494nm,最大发射光波长为514nm。如有需要,也可进一步进行其它荧光的复染。例如使用Annexin V-PE细胞凋亡检测试剂盒(C1065)或Propidium Iodide/碘化丙啶(ST511)检测细胞凋亡、Mito-Tracker Red CMXRos (C1049)检测线粒体活力、Hoechst 33342活细胞染色液(C1027/C1028/C1029)染色细胞核等。注意整个过程均需避光操作。
4.流式细胞仪检测:
a.贴壁细胞胰酶消化后用培养液重悬,悬浮细胞直接使用,计数,取适量细胞250×g室温离心5min,弃上清,加入适当体积的Calcein AM染色工作液,使细胞为单细胞悬液,并且细胞密度为约1×106/ml,每个样品体积为1ml。注:需要准备好仅含缓冲液的细胞样品用作流式细胞仪检测时的阴性对照,该缓冲液与配制Calcein AM染色工作液的缓冲液宜保持一致。
b.37℃避光孵育30min。
c.孵育完成后,250×g室温离心5min收集细胞。每个样品加入1ml缓冲液,轻轻重悬,250×g室温离心5min收集细胞。注:本步骤可去除多余染料及可能引起荧光淬灭的试剂。
d.用400µl缓冲液重悬细胞。如有需要,也可进行进一步染色。例如使用Annexin V-PE细胞凋亡检测试剂盒(C1065)或Propidium Iodide/碘化丙啶(ST511)检测细胞凋亡、Mito-Tracker Red CMXRos (C1049)检测线粒体活力、Hoechst 33342活细胞染色液(C1027/C1028/C1029)染色细胞核等。注意整个过程均需避光操作。染色后,将样品置于冰上,可以在1小时内进行流式细胞仪检测和分析。
e.注意使用仅含缓冲液的并且未经染色的细胞样品用于流式细胞仪的阴性对照设置。Calcein的最大激发光波长为494nm,最大发射光波长为514nm。
