血管生成不仅涉及包括癌症生物学和非肿瘤疾病在内的病理条件,还涉及包括生殖、发育和修复在内的许多生物学过程。在血管生成过程中,内皮细胞(EC)在血管生成因子与其受体结合、释放蛋白酶以溶解基底膜、向血管生成信号迁移、增殖和细胞数量增加以形成新血管后发生激活。最后,内皮细胞的重组形成了三维血管系统。HUVEC管形成测定法是一种简单但公认的体外血管生成测定法,基于内皮细胞在生长因子减少的基底膜提取物凝胶上培养时形成三维毛细管状管状结构的能力。在测定过程中,内皮细胞分化、定向迁移以排列、分支并形成血管的管状多边形网络。
需要准备的试剂:
Dulbecco改良Eagle培养基(DMEM)(高糖L-谷氨酰胺,500毫升)
原代人脐静脉内皮细胞(HUVEC)(启达生物, 货号:CD0290)
ECGM内皮细胞培养基/套装(启达生物, 货号:P1001)
条件培养基(CM)
备注:靶细胞系也可以是那些有或没有药物治疗或表达感兴趣基因的细胞系。
需要准备的耗材:
细胞培养箱
带数码相机的倒置显微镜(尼康TMS)
Scion Image软件
96孔板
离心机
细胞计数器
T25细胞培养瓶
HUVEC成管操作protocol:
A. 从靶细胞系制备条件培养基
1. 为了制备条件培养基(CM),接种靶细胞并生长至30-40%汇合(取决于细胞系的生长速率),用无血清DMEM(例如,对于T75组织培养瓶为10ml;抗生素的存在与否无关紧要)2. 代替生长培养基24小时,然后当细胞在T75组织培养瓶中达到60-80%汇合时收获CM。
如果收集CM后未立即使用,则取0.5 ml CM等分试样,并在-80°C下储存。
B.人脐静脉内皮细胞(HUVEC)细胞的制备
1. 按照培养基配比要求配好ECGM完全培养基。
2. 根据需要将HUVEC细胞接种在T25或T75培养瓶中,使其达到70-80%的融合。
3. 在不含抗生素的培养基200PRF中进行试管形成测定之前,去除血清使HUVEC细胞饥饿3-6小时(例如,对于T25组织培养瓶为5毫升)。
注:在血清饥饿结束时,转至程序C步骤1。
4. 在用生长因子减少的基质胶涂布96孔板后,用胰蛋白酶从烧瓶表面去除细胞,用DMEM与血清中和,在室温下以1200rpm(276xg)离心3分钟使细胞沉淀,重悬于2-3ml无血清DMEM中,通过计数细胞来测定HUVEC的浓度,并通过向上和向下吸移几次以4×105/ml无血清DMEM重悬HUVEC细胞,以确保均匀的单细胞悬浮液。
注:对于生长因子减少的基质胶,应尽可能减少解冻/冷冻周期。
5. 在将500μl HUVEC细胞悬浮液移液到1.5 ml试管中的同时充分混合。使用台式离心机以4000rpm(1100rcf)的转速将细胞降速3分钟。在不干扰细胞沉淀的情况下小心地吸出上清液。尽可能多地去除上清液。根据要使用的靶细胞系的数量,在1.5ml试管中制备适当数量的HUVEC细胞。
注:每个靶细胞系CM将悬浮一管HUVEC,每个悬浮的HUVEC将分配3个一式三份的孔。因此,每个靶细胞系总共将使用3个孔。
6. 解冻从程序a步骤2收集的0.5ml等分的目标细胞系CM,并用胎牛血清将其补充至1%的最终浓度,以在程序B步骤5中重悬HUVEC细胞颗粒。
注:每个靶细胞系应一式三份(每个孔需要100μl HUVEC细胞悬浮液)。
C . 用生长因子减少的基质胶(启达生物,货号SD0054)涂覆96孔板
1. 使用前一天在4°C下解冻适当体积的基质胶。
2. 将96孔板和移液管尖端在-20°C下预冷2-3小时。
3. 在HUVEC细胞血清饥饿接近尾声时,在计数HUVEC之前,在冰上预冷96孔板的每孔中,等分试样50μl的基质胶。旋转铺板,直到凝胶均匀地分布在整个孔上。避免气泡的形成是非常重要的。使其在室温下在水平表面上聚合1小时。
D. 将HUVEC细胞分配到涂布的96孔板上
1. 将100μl程序B步骤6中获得的HUVEC细胞悬浮液完全混合到96孔板的标记孔中。将平板在37°C、5%CO2下培养4-6小时。
2. 用光学显微镜观察细胞。拍摄毛细管网络的图像,并使用Scion Image软件计算管道长度。
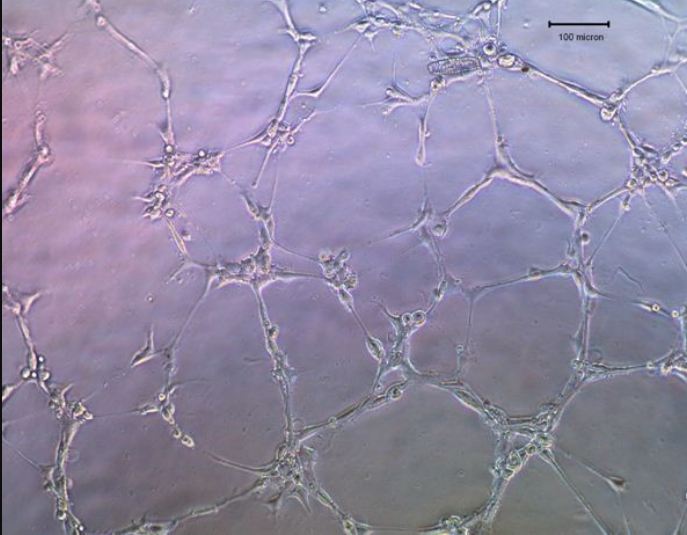 与CM孵育6小时(100x,100μm)后,HUVEC在基质凝胶上成管。
与CM孵育6小时(100x,100μm)后,HUVEC在基质凝胶上成管。
参考文献:
1. Ko, J. M. and Lung, M. L. (2012). In vitro Human Umbilical Vein Endothelial Cells (HUVEC) Tube-formation Assay. Bio-protocol 2(18): e260. DOI: 10.21769/BioProtoc.260.
2. Chan, K. C., Ko, J. M., Lung, H. L., Sedlacek, R., Zhang, Z. F., Luo, D. Z., Feng, Z. B., Chen, S., Chen, H., Chan, K. W., Tsao, S. W., Chua, D. T., Zabarovsky, E. R., Stanbridge, E. J. and Lung, M. L. (2011). Catalytic activity of Matrix metalloproteinase-19 is essential for tumor suppressor and anti-angiogenic activities in nasopharyngeal carcinoma. Int J Cancer 129(8): 1826-1837.
3. Kong, D., Li, Y., Wang, Z., Banerjee, S. and Sarkar, F. H. (2007). Inhibition of angiogenesis and invasion by 3,3'-diindolylmethane is mediated by the nuclear factor-kappaB downstream target genes MMP-9 and uPA that regulated bioavailability of vascular endothelial growth factor in prostate cancer. Cancer Res 67(7): 3310-3319.
请登录上海启达官方网站(http://www.ldraft.com/)查询更多产品
