操作步骤:
1. 将悬浮细胞培养至对数生长期,用PBS洗涤细胞,离心300g,5分钟。去除上清液,重新悬浮细胞至适当浓度(如1×10^5)
2. 接种细胞:用含10%细胞完全培养配成单个细胞悬液,以每孔1000-10000个细胞接种到96孔板,每孔体积200ul。
3. 培养细胞:在37℃、5%CO2的条件下孵育16-48小时,然后在倒置显微镜下观察。
4. 呈色:取出96孔板,将每孔上清液抽出。每孔加入100ul的预先稀释好的MTT溶液(5mg/ml,即0.5%MTT),使细胞与mtt试剂充分接触后,继续培养4小时,使细胞代谢mtt,形成紫色结晶物;
5. 溶解结晶物:对于悬浮细胞,推荐跳过某些步骤并直接进行离心(1000转x10分钟),然后小心吸掉上清液。接着,每孔加入100ul的二甲基亚砜(DMSO),置摇床上低速振荡10分钟,使结晶物充分溶解。
6. 比色:在酶联免疫检查仪上,选择OD570nm(630nm校准)测量各孔的吸光值。
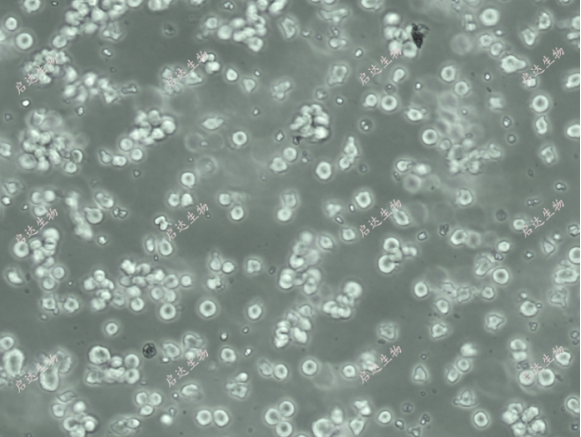
Thp-1 cells Line(启达生物,catlog:CD0122)
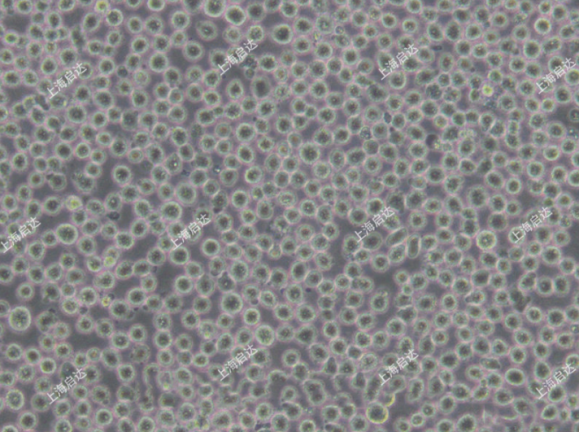
K-562 cells Line(启达生物 catlog:CD0115)
注意事项:
6. 实验环境:确保实验在无菌、无尘、恒温(37℃)和恒湿的环境中进行,以维持细胞的最佳生长条件。
7. 溶解结晶物时应充分振荡,以确保完全溶解。
8. 细胞计数:在接种细胞时,确保准确计数,因为细胞数量直接影响实验结果。
9. MTT溶液:MTT溶液需现配现用,避免长时间储存导致活性降低。
10. 避免交叉污染:在操作过程中,注意更换吸头和管尖,避免不同孔之间的交叉污染。
11. 离心条件:在离心过程中,确保转速和时间设置正确,避免对细胞造成损伤。
12. DMSO操作:DMSO具有一定的毒性,操作时需佩戴防护眼镜和手套,确保安全。
8. 结果解读:OD值的变化反映了细胞的活性,但需注意排除其他可能干扰因素,如培养基的颜色、气泡等。
9. 实验记录:详细记录实验过程中的所有操作和环境条件,以便后续分析和复查。
以上步骤和注意事项完成后,可以确保实验的准确性和可靠性,从而得到准确的细胞活性数据。
