
胃癌(GC)是世界上最常见和最致命的胃肠道恶性肿瘤之一,尽管幽门螺杆菌(Helicobacter pylori)被认为是GC的前体事件和随后发展的重要病因,研究发现,根除H. pylori并不能完全逆转肠上皮化生进展。最近的临床横断面研究表明,胆汁反流(BR)是GC癌前病变和胃癌发生的独立危险因素。近日,麦特绘谱创始人贾伟教授和上海交通大学附属第六人民医院赵爱华教授及其研究团队,首次揭示了胆汁酸-微生物在胆汁反流性胃炎引起的胃癌中的作用及分子机制。研究证实结合型胆汁酸与致炎性微生物的增殖在促进胃癌病变中的有害作用,并指出中药丹参中的一种有效成分隐丹参酮能有效抑制胆汁反流引起的胃癌前病变。这一结果为针对胆汁反流性胃炎的癌变提供了新的预防和治疗策略。研究成果发表在《Advanced Science》。
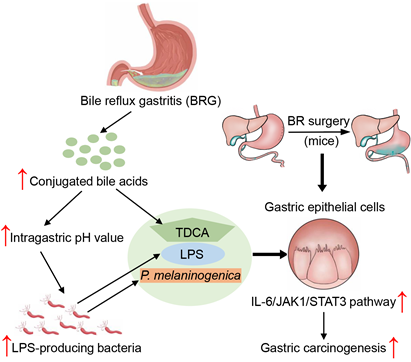
图1. 胆汁酸-菌群促进胆汁反流性胃癌发生的机制
研究结果
1. 胆汁反流性胃炎与胃癌前病变密切相关
通过靶向定量代谢组比对了健康人(n=50)、胆汁反流性胃炎患者(BRG)(n=50)和胃癌患者(GC)(n=45)胃液中胆汁酸的水平。结果表明BRG和GC患者胃液胆汁酸水平显著性升高,其中结合性胆汁酸成分包括甘胆酸(GCA)、甘氨鹅去氧胆酸 (GCDCA)、甘氨去氧胆酸 (GDCA)、甘氨熊去氧胆酸 (GUDCA)、牛磺胆酸 (TCA)、牛磺鹅去氧胆酸 (TCDCA)、牛磺去氧胆酸(TDCA)和牛磺熊去氧胆酸 (TUDCA)均显著性升高。研究人员进一步通过相关分析发现BRG和GC患者中TDCA水平与胃液pH值的改变呈现最强的正相关关系。
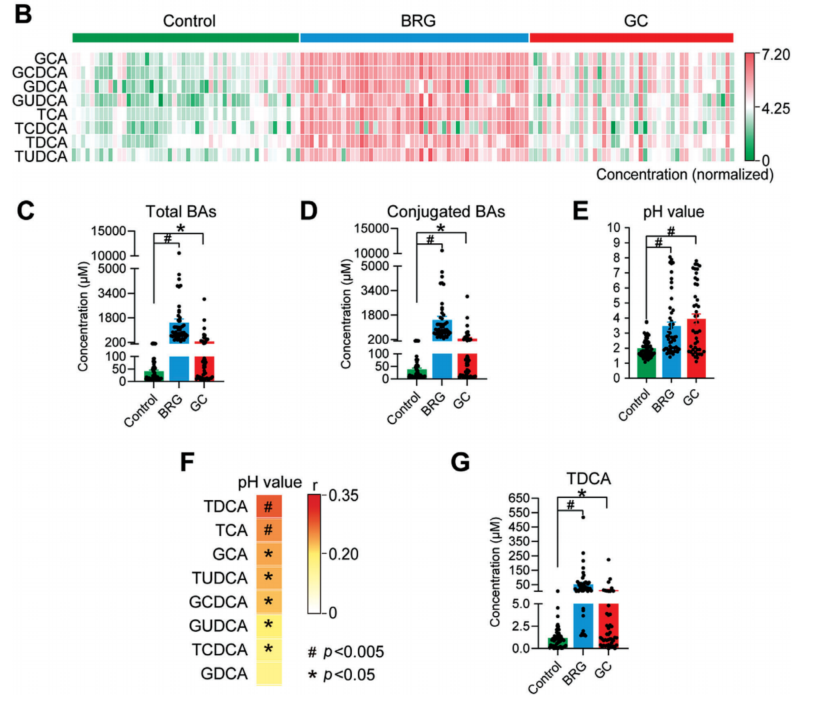
图2. 三组胃液中胆汁酸水平及与pH值的相关性
2. 结合型胆汁酸和产LPS微生物丰度的增加促进胃癌发生
以往研究表明胆汁反流与慢性胃炎密切相关。本研究对BRG和GC患者胃液中炎症因子水平进行评估,发现BRG和GC患者胃液中炎性因子水平,以及脂多糖(LPS)水平明显升高。对胃液中微生物的分析研究发现,具有产LPS的微生物丰度水平明显升高,同时产LPS的功能也明显增强。
随后,研究人员通过细胞实验和动物实验探究了TDCA和LPS是否会促进胃炎的发生。在细胞水平上,研究发现TDCA和LPS均能够加速胃上皮细胞的增殖及克隆形成,并激活诱导炎性和癌症发生的信号通路IL-6/JAK1/STAT3。在动物研究中,TDCA、LPS以及产LPS的细菌(Prevotella melaninogenica)干预小鼠,均导致炎症因子IL-6水平及基因表达显著升高,并激活 STAT3信号通路,证实TDCA、LPS及P. melaninogenica确实能促进小鼠炎性和癌症信号通路的激活,并诱导胃炎的发生。
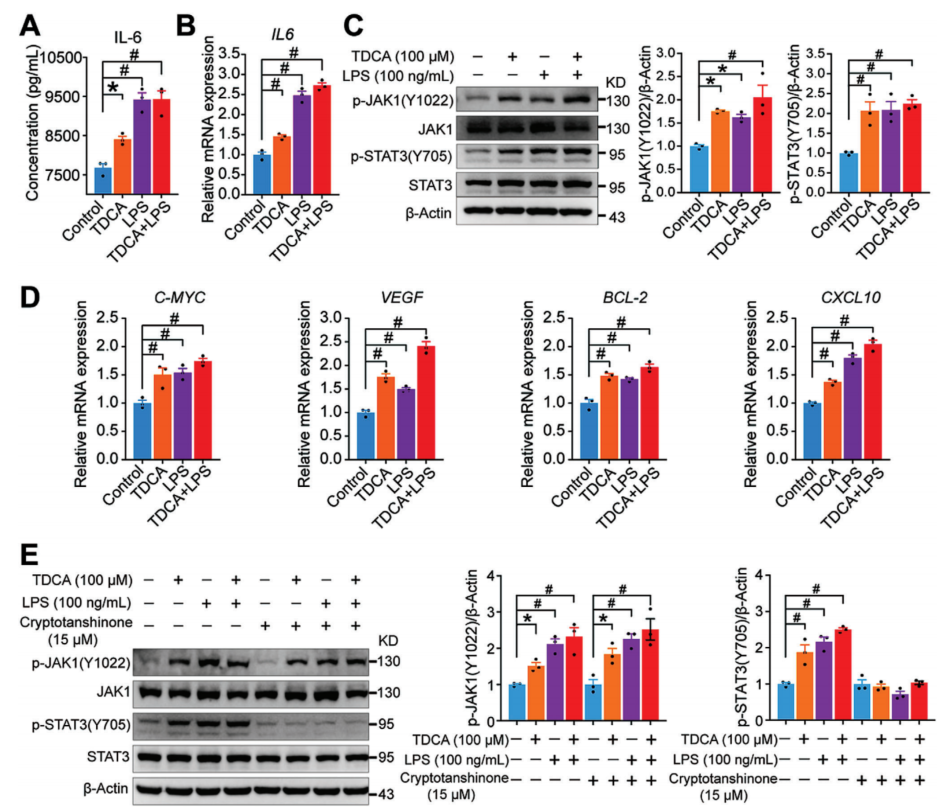
图3. TDCA和LPS通过激活胃上皮细胞中的IL-6/JAK1/STAT3通路来促进胃癌的发生
3. 胆汁反流诱导胃癌发生,隐丹参酮能有效改善癌前病变
为了使研究结果更能真实地反映临床胆汁反流及胆汁反流所诱导胃癌的发生,研究人员进一步采取在小鼠上进行肠胃吻合手术,成功建立模拟临床胆汁反流的模型小鼠,证实胆汁反流及P. melaninogenica确实能通过激活IL-6/JAK1/STAT3通路促进胃癌前病变的发生。同时中药丹参中一种重要活性物质成分—隐丹参酮(cryptotanshinone)的使用,能有效地阻止炎性信号通路的激活,从而抑制胃癌前病变的发生。

图4. 胆汁反流引起胃癌发生,隐丹参酮对小鼠具有靶向治疗作用
小结
本研究揭示了胆汁酸和微生物在胆汁反流性胃炎、胃癌中的重要作用及分子机制,为胆汁反流导致的炎症和癌症的预防提供了一种有效的天然药物,对进一步的药物研究开发具有非常重要的意义和价值。同时,研究团队建立的更贴近临床的胆汁反流小鼠模型,为后续进行胆汁反流相关的研究提供了一种确实可行的动物模型。
参考文献
Bile Acid–Microbiome Interaction Promotes Gastric Carcinogenesis. Advanced Science. 2022. DOI: 10.1002/advs.202200263.
原文阅读,请扫描下方二维码

往期推荐
2. 客户案例 | 胆道梗阻、胆道引流和胆汁回输对小鼠胆汁酸代谢和肠道菌群的影响
3. Journal of Hepatology | STARD1通过胆汁酸促进NASH向肝癌发展
4. 客户案例 | 大豆皂甙A2调控胆汁酸与肠道微生物改善非酒精性脂肪性肝炎
5. Nature | 百岁老人不易得慢性病被解密:体内富含新的胆汁酸生物合成途径
6. Protein&Cell | 胆汁酸替代合成途径与代谢性疾病

