终末期肾病(ESRD)是慢性肾脏疾病(CKD)的晚期阶段,其发生发展与血液中毒性代谢物的积累密切相关。其中许多是源于肠道菌群的毒素,且难以通过透析有效清除。已有研究报道CKD患者肠道菌群结构存在显著改变,ESRD患者血液透析后血液和粪便代谢失调,提示CKD中存在肠道菌群介导的代谢失调,但ESRD相关代谢产物(如尿毒症毒素)的微生物起源以及菌群介导的ESRD代谢变化的机制尚未得到充分研究。中国农业大学任发政院士和于政权教授及其团队对223例ESRD患者和69例匹配的健康对照进行了多组学分析并用无菌动物实验验证了肠道菌群对毒素累积和疾病表型的影响,揭示了患者肠道菌群失调与代谢紊乱和肾病临床表型之间的关系,相关研究成果发表于《Gut》。
ESRD患者血清与粪便代谢组分析
采用非靶向代谢组学技术对223例ESRD患者及其匹配的69例健康对照的血清样本进行分析,共鉴定出180种代谢物,其中134种具有显著差异。将患者按照原发疾病类型分为三个亚组:肾小球肾炎(n=76)、糖尿病肾病(n=73)和其他(n=74),并分别与对照组进行比较,结果显示三种情况下的差异代谢物较为相似。而ESRD是造成差异的主要原因,因为它解释了接近11%的变异,其他生物临床变量(如性别、体重和总血液胆固醇浓度)共同解释了额外的8.5%(图1B)。
ESRD血清代谢谱的主要特征是9种尿毒症毒素富集和胆汁酸组成失衡(即结合型 vs 非结合型胆汁酸、初级 vs 次级胆汁酸(SBAs))(图1C)。随后研究人员对随机选择的40例ESRD患者和20例健康对照血清中差异代谢物进行定量分析并验证了ESRD患者尿毒症毒素的积累。据报道,除了由细菌分解胆碱和肉碱而产生的氧化三甲胺(TMAO),这些毒素主要是由肠道菌群降解饮食中的芳香族氨基酸(AAAs)和多酚而产生。血清代谢物聚类后与临床变量进行相关分析结果显示,尿毒症毒素和胆汁酸在内的簇与相关临床变量(如血肌酐和肾小球滤过率)密切相关,表明这些代谢物的变化对患者的临床生理状态的重要性。
粪便代谢组学分析共鉴定出225种代谢物,其中98种在两组中具有显著差异。患者粪便中尿毒症毒素前体和SBAs呈现富集,而初级BAs、短链脂肪酸(SCFAs)及其衍生物(如甲基丁酸和甲基丙酸)显著降低,这些代谢物解释了粪便代谢组变化的49.6%。Procrustes分析发现血清和粪便代谢谱具有很强的协同作用(图1F),ESRD患者肠道代谢改变促进了血清尿毒症毒素的积累。进一步纳入包括12例ESRD患者和12名健康对照的独立队列,证实了ESRD患者血清尿毒症毒素的积累,同时患者粪便中毒素前体的升高也伴随着SCFAs及其衍生物明显降低的趋势。
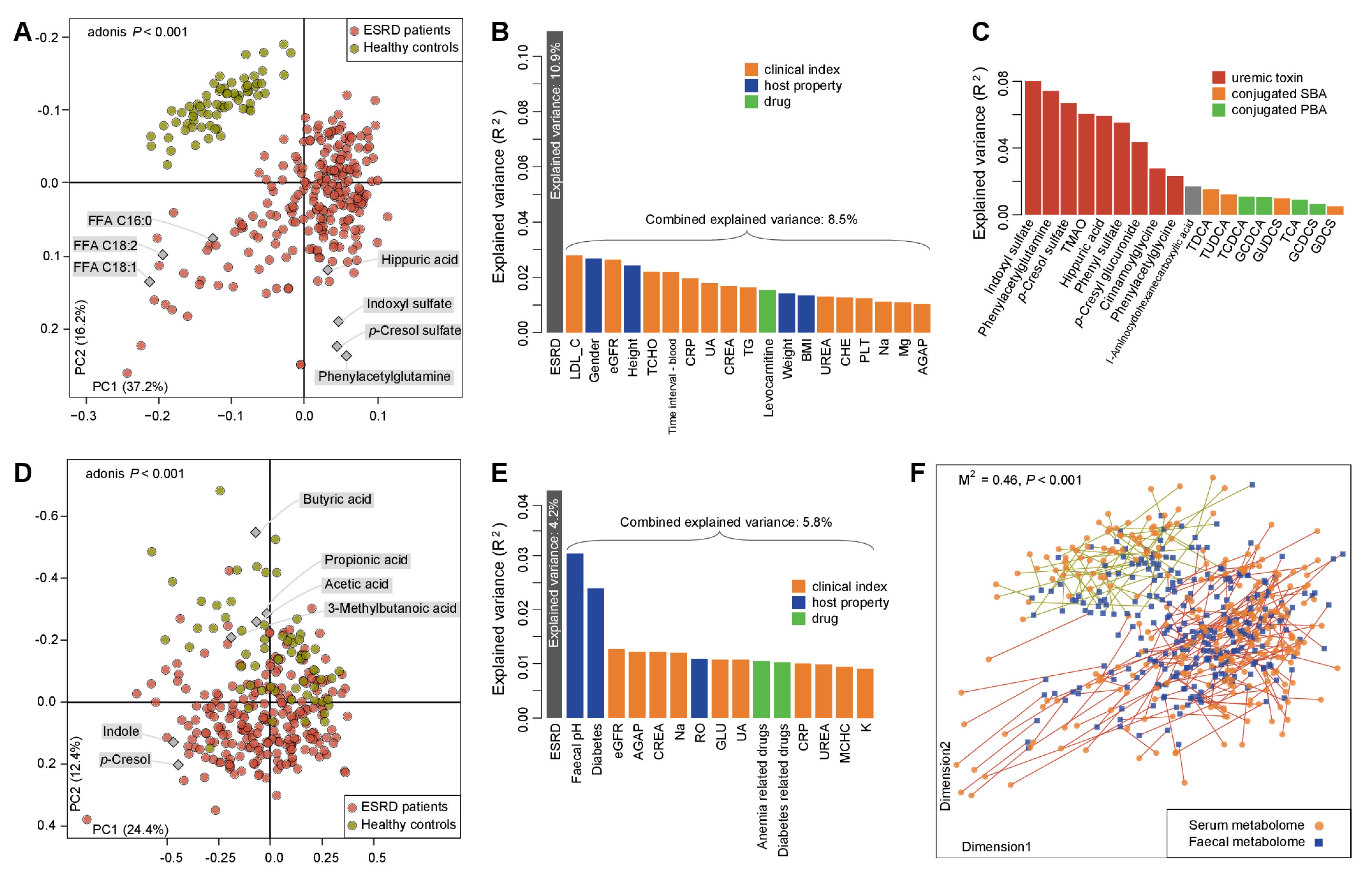
图1 ESRD患者相关的血清和粪便代谢组学分析
ESRD患者微生物组成和功能特征
研究人员对粪便样本进行宏基因组分析,结果显示,相较于健康对照组,ESRD患者的Eggerthella lenta, Flavonifractor plautii、Alistipes finegoldii、A. shahii、Ruminococcus spp和Fusobacterium spp显著富集,而Prevotella copri、Clostridium spp和几种产丁酸的菌减少(图2B)。ESRD患者粪便中SCFAs的减少可能是由产SCFA的菌丰度降低所致,并且氨基酸生物合成降低而分解提高可能反映了ESRD患者的氨基酸利用率增加。另外,参与AAA降解和SBA生物合成的功能模块在ESRD患者中显著富集,与粪便代谢组中发现的尿毒症毒素和SBA累积一致。因此,ESRD患者中尿毒症毒素的富集与肠道菌群介导的AAA降解和微生物SBA生物合成有关。
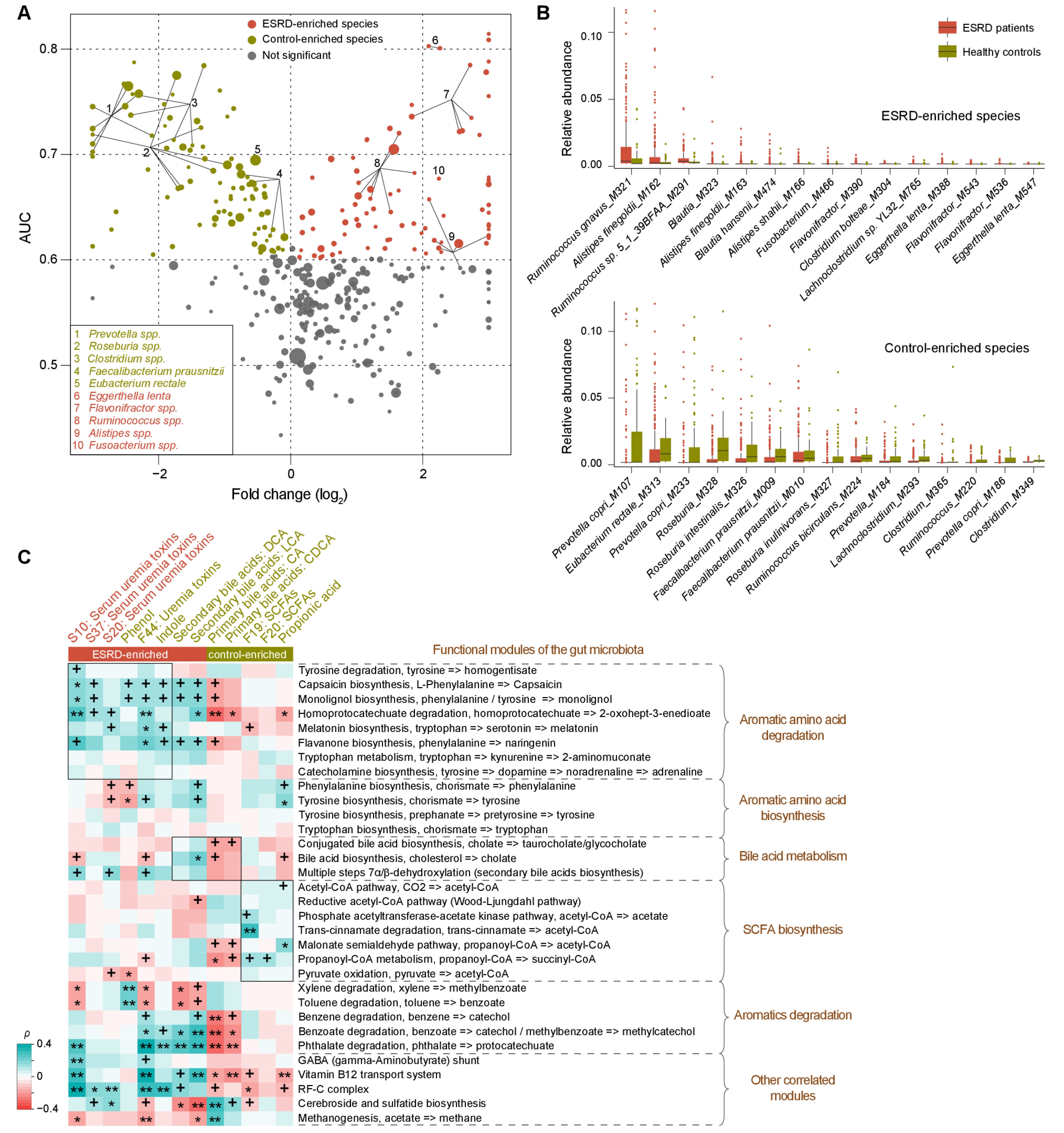
图2 ESRD患者肠道菌群特征及其与血清和粪便代谢物的关系
肠道菌群与代谢物关联分析
研究人员对肠道MGSs丰度、血清和粪便代谢物进行相关分析,发现在ESRD患者和健康对照组中三者之间均存在紧密联系(图3A, 3B)。其中尿毒症毒素和胆汁酸占ESRD患者血清代谢物相关性的95.0%,远远超过对照组的69.3%,ESRD患者中血清尿毒症毒素和胆汁酸同时受肠道菌群和粪便代谢物的显著影响(图3C)。此外,肠道菌群对ESRD患者代谢谱的影响是可观的,分别占血清和粪便31.3%和39.0%(图3D)。因此,除了肾功能外,肠道微生物似乎是宿主粪便和血清代谢谱的重要决定因素。

图3 ESRD患者肠道菌群影响宿主血清和粪便代谢谱
ESRD相关菌群促进患者体内毒素的积累并与疾病的临床特征有关
为进一步证实肠道菌群在尿毒症毒素和SBA产生中的潜在作用,研究人员对编码这些化合物主要合成途径中至关重要酶的微生物基因进行了分析,共确定5134个编码6种主要尿毒症毒素和SBA关键合成酶的基因,这些基因在ESRD患者及其富集的肠道微生物中更为丰富,粪便中代谢物的浓度与同源合成酶编码基因的丰度呈正相关。利用随机森林模型确定每种毒素或SBA与含有毒素/SBA合成酶编码基因的物种丰度之间的相关性,鉴定出83个显著相关的菌种(图4)。这些模型平均解释了26%的血清和粪便代谢物变异,提示这些菌种主要贡献毒素和SBA的产生。尿毒症毒素或SBA产生相关的微生物基因与最重要的ESRD临床变量显著相关,尤其是eGFR、肌酐、尿素、C反应蛋白和血红蛋白的水平与微生物物种丰度显著相关。因此肠道微生物组成可通过尿毒症毒素和SBA的累积加剧ESRD症状。
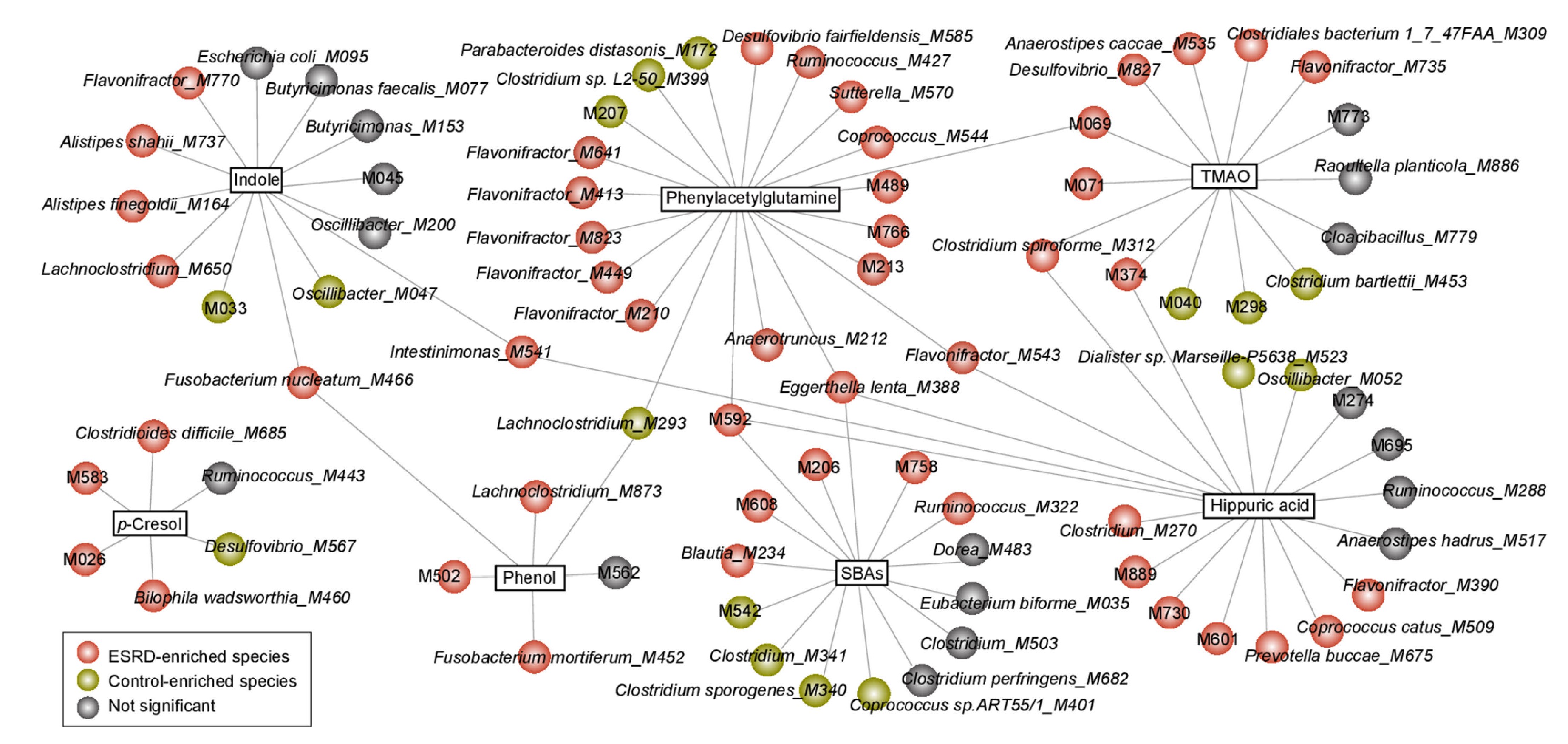
图4 尿毒症毒素/SBAS和MGSs的网络联系
肠道菌群的改变影响毒素的累积并加剧肾病恶化
为了验证肠道菌群通过毒性代谢物来驱动肾衰竭的假说,研究人员进行了粪菌移植实验。结果显示,与对照组的受体小鼠相比,移植ESRD患者菌群的小鼠表现出更严重的肾纤维化、肾小球硬化和氧化应激,以及血清尿素和肌酐水平的升高(图5B, 5C),并且血清中几种尿毒症毒素(包括硫酸对甲酚、苯乙酰甘氨酸、硫酸苯基和硫酸吲哚)水平显著升高(图5D)。为了验证特定的菌种是否能够通过产生尿毒症毒素来促进肾病进展,作者又选择了两种菌进行了单菌移植实验,其中E. lenta是ESRD患者中富集程度最高的微生物物种之一,可将多酚降解为苯甲酸或4-羟基苯甲酸,与马尿酸、苯乙酰谷氨酰胺和SBA等多种毒素的产生有关。F. nucleatum参与吲哚和苯酚等物质的产生,并且此菌在大肠癌中被认为是一种促炎性细菌。结果表明单菌移植对整体肠道菌组成无显著影响,但血清尿毒症毒素水平显著升高,同时肾纤维化、肾小球硬化和氧化应激加剧,以及血清尿素和肌酐水平升高。因此,ESRD患者肠道菌群产生的尿毒症毒素可加剧肾病的恶化。
最后,研究人员对CKD大鼠进行Bifidobacterium animalis A6灌胃,发现尽管微生物总体组成未发生显著变化,但E. lenta和Fusobacterium spp丰度显著降低,并且血清尿毒症毒素、肌酐、尿素浓度明显降低,肾纤维化和肾小球硬化减轻,表明益生菌菌株可通过调节产毒素的细菌丰度来减轻大鼠肾脏疾病。
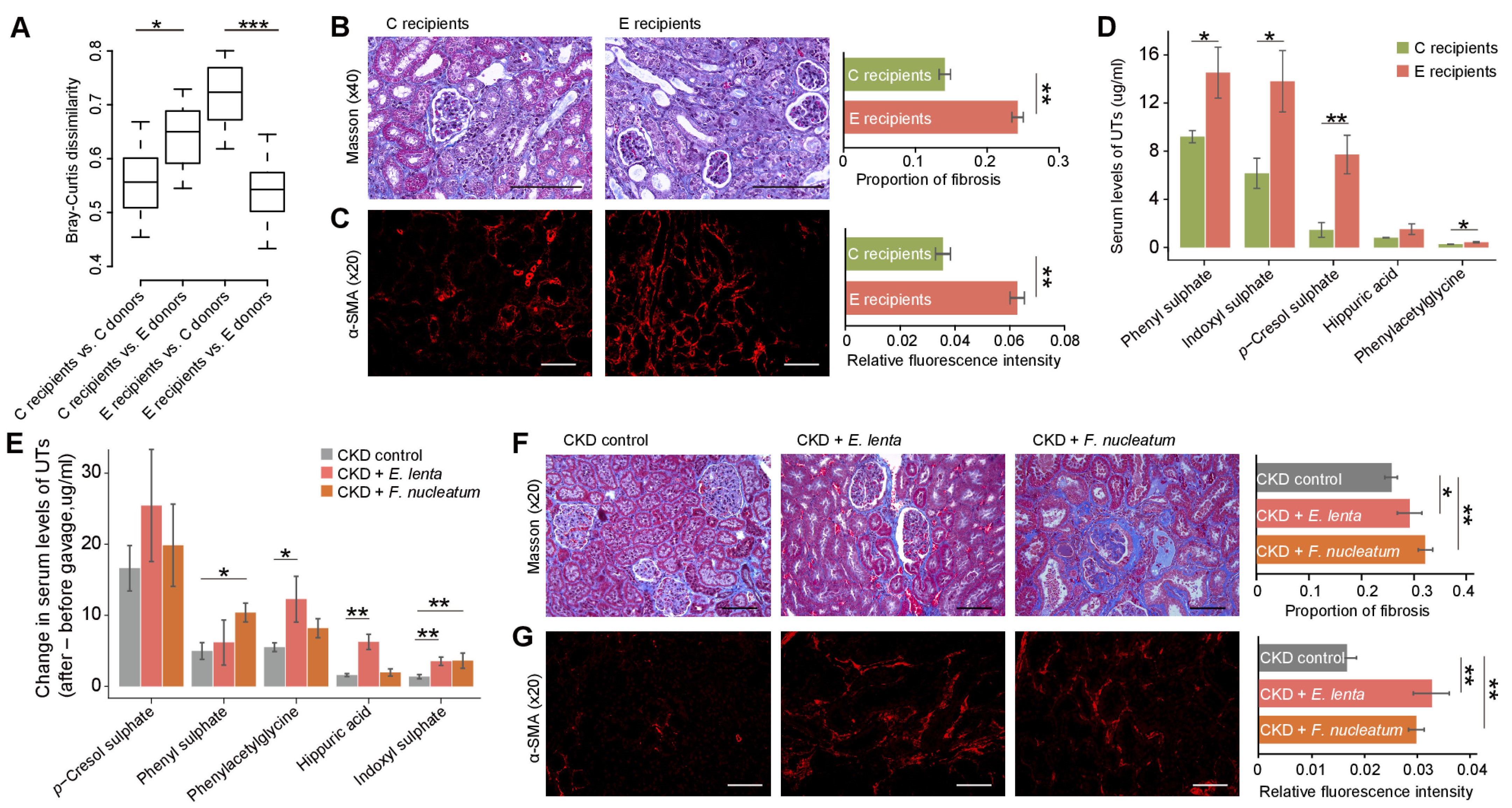
图5 动物实验验证ESRD菌群及Eggerthella lenta 和Fusobacterium nucleatum产血清尿毒症毒素和加重肾病的作用
小结
本研究通过血液代谢组、粪便代谢组与微生物组分析逐步揭示了ESRD患者肠道菌群改变是导致其粪便和血液代谢失调的重要原因,发现ESRD患者血清尿毒症毒素和SBA的累积与肠道菌群介导的AAA降解和SBA合成的增加有关,进一步利用动物模型阐明了肠道细菌通过毒性代谢物影响肾病的机制,提示调节肠道菌群有望成为降低患者尿毒症毒素的靶点,为ESRD的辅助治疗提供了新的思路和理论支持。

图6 肠道菌群的改变引起ESRD加重的机制
参考文献
Wang X, et al. Aberrant gut microbiota alters host metabolome and impacts renal failure in humans and rodents. Gut 2020. doi:10.1136/gutjnl-2019-319766.
原文阅读,请长按识别下方二维码

精彩推荐
2. Nature Communication | 肠道菌群代谢物--苯基硫酸盐促进糖尿病肾病蛋白尿
4. Cell Metabolism | 肠道菌群相关代谢物--胆汁酸生物学功能
5. TEM | 宿主与菌群互作的信号分子--AAA相关菌群代谢物
6. Nature Medicine | 代谢组学和宏基因组学共同揭示CRC与肠道菌群的关系
7. Cell︱菌群代谢物-苯乙酰谷氨酰胺-心血管疾病又一推手

