一、皮肤组织的结构
皮肤指披覆在人体的表层,直接与外界环境相接触的组织。皮肤是人体最大的器官之一,约占体重的16%。皮肤可以分为三大层,从内到外依次为皮下组织、真皮层和表皮层。表皮层是人体最外面的一层组织,属于复层鳞状上皮。角质形成细胞又称上皮细胞,占表皮细胞的95%以上,代谢活跃,能连续不断的进行细胞分化和更新。在其分化和成熟的不同阶段,细胞的形态、大小及排列均有不同。根据角质形成细胞各发展阶段的特点,将表皮分为5层,由内向外依次分为基底层、棘层、颗粒层、透明层和角质层,反映了表皮细胞在角质化过程中的演变,其中基底层、棘层又合称表皮生发层。角质层由多层角化上皮细胞(核及细胞器消失,细胞膜较厚)构成,无生命,不透水,具有防止组织液外流,抗磨擦和防感染等功能。生发层的细胞不断增生,逐渐向外移行,以补充不断脱落的角质层。生发层内含有一种黑色素细胞,能产生黑色素。皮肤的颜色与黑色素的多少有关。真皮层由致密结缔组织构成,由浅入深依次为乳头层和网状层,两层之间无明显界限。乳头层与表皮的生发层相连,其中有丰富的毛细血管、淋巴管、神经末梢和触觉小体等感受器。网状层与皮下组织相连,其内有丰富的胶原纤维,弹力纤维和网状纤维。它们互相交织成网,使皮肤具有较大弹性和韧性。皮下组织分布于真皮和肌膜之间,上方与真皮、下方与肌膜紧密连接,广泛分布于体表,形成所谓脂肪层。皮下脂肪层是储藏能量的仓库,又是热的良好绝缘体,此外还可缓冲外来的冲击,保护内脏器官。
二、皮肤组织的研究方向及研究方法
皮肤组织功能
保护:这是皮肤最重要的功能。皮肤充当了一道与外界隔绝的屏障。皮肤还携带蛋白质(角蛋白)和色素(黑色素)。黑色素作为光敏色素能高效抵御紫外线,确保生物不会被太阳光线过度伤害。
感觉:皮肤是人体的主要感觉器官之一。皮肤能感知触觉、热量、压力、寒冷等,被躯体感觉受体所覆盖,这些受体将这些感觉作为信号传递给大脑。因此,生物可以对特定的刺激做出适当的反应。
温度调节:这是皮肤的另一个主要功能。皮肤内的汗腺将汗液释放到皮肤外层,然后蒸发排出身体热量。鸡皮疙瘩现象也是一种温度调节反应。
储存:皮肤可以在其组织中储存脂质和水分,从而为身体提供额外的绝缘。
分泌气味信号:皮肤汗腺分泌的汗液也可以作为其他生物体的信号。
内分泌:皮肤有助于维生素D的合成。当皮肤暴露在大量的紫外线下,比如太阳光(人造光也起作用),皮肤的基底层和棘层会产生维生素D3。这是因为在皮肤中发现的一种化学物质,即7-脱氢胆固醇,会与紫外线发生反应。但过度暴露于紫外线会引发多种皮肤问题。
皮肤疾病
皮肤作为人体的第一道生理防线和最大的器官,时刻参与着机体的功能活动,维持着机体和自然环境的对立统一,机体的异常情况也可以在皮肤表面反映出来。皮肤病是影响皮肤的疾病。这些疾病可能导致皮疹、炎症、瘙痒或其他皮肤变化。有些皮肤病是轻微的,有些会引起严重的症状。一些最常见的皮肤病包括:痤疮、黄褐斑、湿疹、牛皮癣、酒渣鼻、白癜风等。许多罕见的皮肤病是遗传的,包括:光化性痒疹、银屑病、多汗症、遗传性大疱性表皮松懈症、鱼鳞病以及家族性良性慢性天疱疮等。
某些生活方式因素可能会导致皮肤病的发生。潜在的健康状况也会影响皮肤。皮肤病的常见原因包括:毛孔或毛囊被细菌堵塞;影响甲状腺、肾脏或免疫系统的疾病;接触环境诱因,例如过敏原或他人的皮肤;遗传学因素;皮肤上的真菌或寄生虫;药物,例如治疗炎症性肠病(IBD)的药物;病毒;糖尿病以及太阳光。
AAV在皮肤组织中的研究
全球每年有30万人因皮肤创伤而致死,其中绝大部分都是因伤口难以愈合,感染休克而死亡。伤口愈合依赖于基层角质细胞,但伤口处往往极度缺失此种细胞。
案例一:AAV在猪皮肤中的表达
本研究通过对小型猪皮内注射AAV载体,发现AAV不仅存在于分裂和有丝分裂后的表皮角质形成细胞中,也存在于毛囊上皮细胞和外泌汗腺中,这表明AAV有望进一步利用毛囊靶向和通过皮肤对肿瘤或感染因子进行免疫。
图1. 皮内注射AAVlacZ后的猪皮肤组织切片β-半乳糖苷酶染色
案例二:利用AAV2型载体转导体外构建重组皮肤
腺相关病毒2型(AAV2)是皮肤基因治疗的有效载体,因为皮肤是AAV的天然宿主组织,在其中它作为一种自主性细小病毒发挥作用。
本研究证明携带粒细胞-巨噬细胞集落刺激因子(GM-CSF)、人乳头瘤病毒E6或绿色荧光蛋白(GFP)转基因的rAAV载体可以转导离体培养的原代人角质形成细胞。通过使用器官型上皮筏培养系统,作者进一步证明,这些转导的细胞可用于形成转基因阳性重组皮肤。
图2. GM-CSF阳性和阴性皮肤组织切片H&E染色
图3. AAV/E6/Neo转导产生的重组皮肤的免疫组织化学分析(E6抗体)
AAV载体在皮肤组织中基因治疗的应用
案例一:通过编码人血管内皮生长因子165(VEGF165)的重组AAV载体促进伤口愈合
人的皮肤由表皮、真皮、皮下组织三层构成,当皮肤组织因内外源压力导致离断或破损,抵抗力下降时,过于薄弱的肌肤屏障就无法抵御外界刺激,创面难愈或不愈的发生率不断攀升。伤口愈合是一个非常复杂的过程,包括炎症期、增生期、瘢痕形成期和组织再塑等阶段。
治疗基因的递送代表了加速难以治疗伤口愈合的诱人可能性。实验证据表明,在这种情况下,伤口处新生血管生成的增强可能是一个重要的治疗靶点。
通过将VEGF165递送至大鼠的全层切除伤口,能显著诱导新生血管的形成,从而缩短愈合时间。经治疗伤口的组织学检查也显示,表皮和真皮的重塑加快,形成了一层厚厚的颗粒层,并包含许多新形成的毛细血管,以及更大管径的血管。这些数据强调了新血管生成在愈合过程中的重要性,并表明VEGF基因转移可能代表了一种治疗伤口愈合障碍的新方法。
图4. AAV-VEGF165诱导新生血管生成
图5. AAV-LacZ和AAV-VEGF165对大鼠皮肤创伤的转导(β-半乳糖苷酶染色及VEGF抗体免疫组织化学分析)
案例二:利用AAV载体将伤口驻留细胞(伤口溃疡处其他细胞)进行重编程成类干细胞,帮助伤口愈合重新长出新皮肤
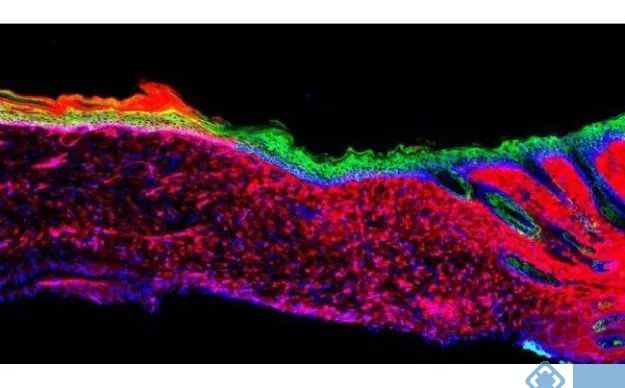
基于AAV的体内重编程小鼠皮肤模型:间充质细胞(红色)在四种因子的作用下转化为基底角质形成细胞(绿色),形成上皮(皮肤)组织
表皮是身体的最外层,多层表皮由基底层1(即基底角质形成细胞)内的干细胞和祖细胞维持。修复受损皮肤的一个重要步骤是从邻近表皮迁移角质形成细胞到伤口处以促进再上皮化。对于大伤口,这个过程效率很低。为了改善患者的预后,必须开发更快速有效的再生表皮覆盖方法,最好是非手术干预。近年来细胞重编程研究有了迅猛进展,于是作者推断伤口驻留细胞也可拥有被重新编程为表皮祖细胞的命运,进而产生新的上皮细胞,最终促进皮肤溃疡表面的从头上皮化。
而间充质细胞参与伤口愈合,于是研究人员最初试图重编程间充质细胞(人真皮成纤维细胞hDFs;脂肪来源基质细胞hADSCs),并通过比较人类角质形成细胞和原代hDFs的基因表达谱,上游启动子分析及基因表达逆转分析,作者鉴定出55个转录因子和31个microRNAs可能与角质形成细胞特异性有关。
然后,通过反复测试以及对每个潜在的重编程因子进行进一步实验,最终确定了4个因子(DNP63A、GRHL2、TFAP2A和MYC,简称DGTM因子),它们可以介导基底角质细胞转化。其中DNP63A和GRHL2可以将皮肤间充质细胞重编程变成皮肤细胞前体;MYC则有助于提高重编程效率,并促进细胞增殖和分层;TFAP2A负责加速小皮肤细胞团块汇聚集合。为了在体内测试DGTM因子,遂选择使用AAV,但由于AAV不同血清型的细胞向性不同,通过皮下注射或直接应用表达绿色荧光蛋白AAV(GFP-AAV)的方式确定哪种AAV有效治疗孤立性溃疡。结果表明AAVDJ组GFP表达水平最高。
当用AAV递送上述4个因子局部处理小鼠皮肤溃疡时,溃疡处在18天内生长出了健康的皮肤(称之为上皮细胞)。随着时间的推移,即便溃疡面很大,这些上皮细胞也能不断扩大并与周围皮肤连接,并最终覆盖整个溃疡面。3-6个月后,新生成的上皮细胞在多种分子、基因和细胞测试中都表现得如正常皮肤细胞一般。
图6. DGTM因子通过体内重编程生成上皮组织(H&E染色)
三、AAV感染皮肤组织的血清型
研究显示,衣壳是载体趋向性的主要决定因素。通过使用另一种AAV血清型的衣壳取代AAV2的衣壳,而AAV血清型衣壳的变化可能导致它们独特的组织趋向性。
通过在小鼠背部皮肤皮下注射,在CAG启动子下表达eGFP的18种血清型AAV(1E+9GC,100μL),AAVDJ表达的GFP荧光最强[4]。
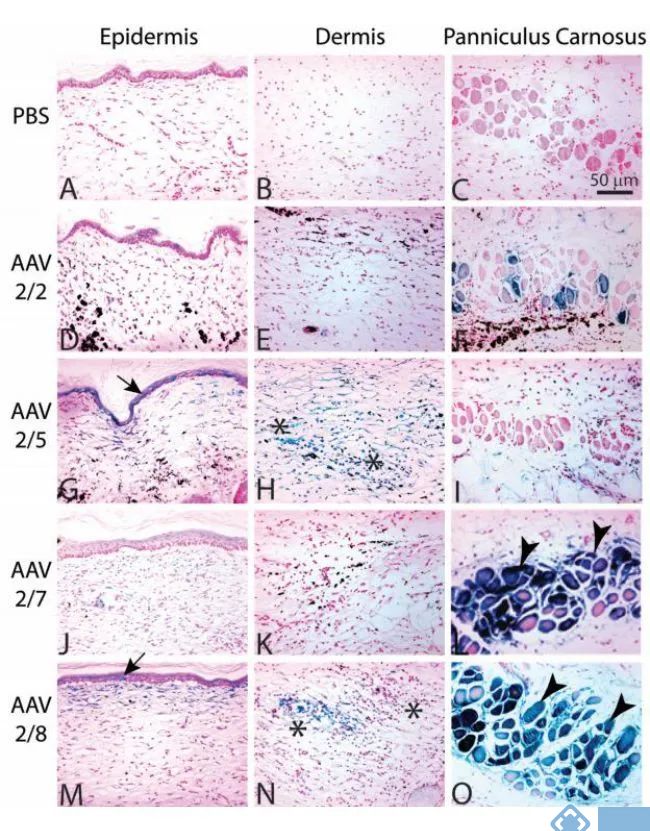
通过构建鼠切除创伤模型,比较AAV2/2和三种假型AAV载体AAV2/5、AAV2/7和AAV2/8对表皮细胞、真皮细胞和肌膜束的转导效率。与AAV2/2相比,AAV2/5和AAV2/8显著增强表皮和真皮中细胞的转导。AAV2/5转导基底和基底上角质形成细胞。相反,AAV2/8主要转导基底上的角质形成细胞。与AAV2/2相比,AAV2/7和AAV2/8在肌膜束中的转导效率较高。
图7. C57BL/6J小鼠创伤后28天的伤口(表皮、真皮、肌膜束)
图8. AAV2/2与假型载体AAV2/5、AAV2/7和AAV2/8在创伤处转导效率的比较
四、AAV感染皮肤组织的途径及剂量
AAV感染皮肤组织的方式主要通过皮内注射,也有通过静脉注射方式感染。
五、皮肤组织损伤中常用的小鼠品系
六、参考文献
1. Hengge UR, Mirmohammadsadegh A. Adeno-associated virus expresses transgenes in hair follicles and epidermis. Mol Ther. 2000 Sep;2(3):188-94.
2. Agrawal N, You H, Liu Y, et al. Generation of recombinant skin in vitro by adeno-associated virus type 2 vector transduction. Tissue Eng. 2004 Nov-Dec;10(11-12):1707-15.
3. Deodato B, Arsic N, Zentilin L, et al. Recombinant AAV vector encoding human VEGF165 enhances wound healing. Gene Ther. 2002 Jun;9(12):777-85.
4. Kurita M, Araoka T, Hishida T, et al. In vivo reprogramming of wound-resident cells generates skin epithelial tissue. Nature. 2018 Sep;561(7722):243-247.
5. Keswani SG, Balaji S, Le L, et al. Pseudotyped adeno-associated viral vector tropism and transduction efficiencies in murine wound healing. Wound Repair Regen. 2012 Jul-Aug;20(4):592-600.
如有相关实验需求,请咨询我们!
我司重磅推出环路示踪,光遗传,钙记录,膜片钳,电生理等动物实验服务!
公司相关业务:
神经环路示踪病毒载体、基因编辑(敲入、敲除、点突变、敲低)、基因过表达/干扰服务、行为学小鼠模型构建、干细胞诱导分化、整包服务等。