
期刊:Computers in Biology and Medicine
影响因子:6.929
伯豪服务产品:单细胞核测序、伯优®细胞核分离试剂盒
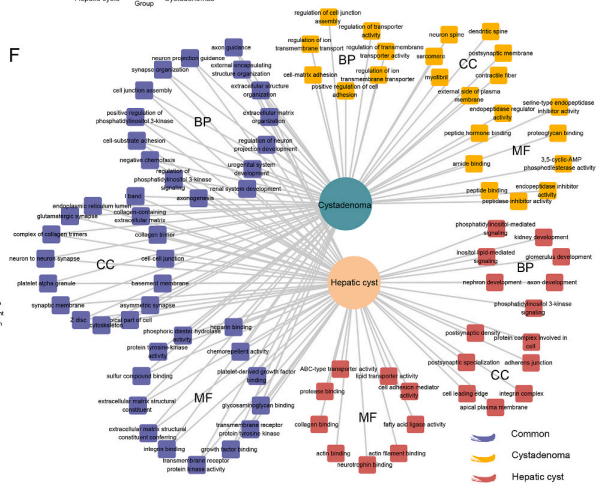
肝囊腺瘤是一种罕见疾病,占所有囊性病变的约5%,具有较高的恶性转化倾向。术前诊断囊腺瘤较为困难,一些囊腺瘤在初诊时容易被误认为肝囊肿。肝囊肿是一种相对常见的肝脏疾病,大多数为良性,但较大的肝囊肿可能导致胆管受压,从而引起肝功能异常。近年来,对囊腺瘤和肝囊肿的研究越来越多,但大多仍停留在传统的病例分析或临床报告中,缺乏对囊腺瘤、肝囊肿的高通量研究。
研究目的
为了深入剖析囊腺瘤与肝囊肿的差异,本研究通过对囊腺瘤和肝脏囊肿样本进行单核RNA测序和空间转录组测序,旨在揭露肝囊肿和囊腺瘤的微环境差异和分子特征,为囊腺瘤的诊断提供新的视角。
1. 通过构建囊腺瘤、肝囊肿的图谱,揭示两者在细胞组成上的差异
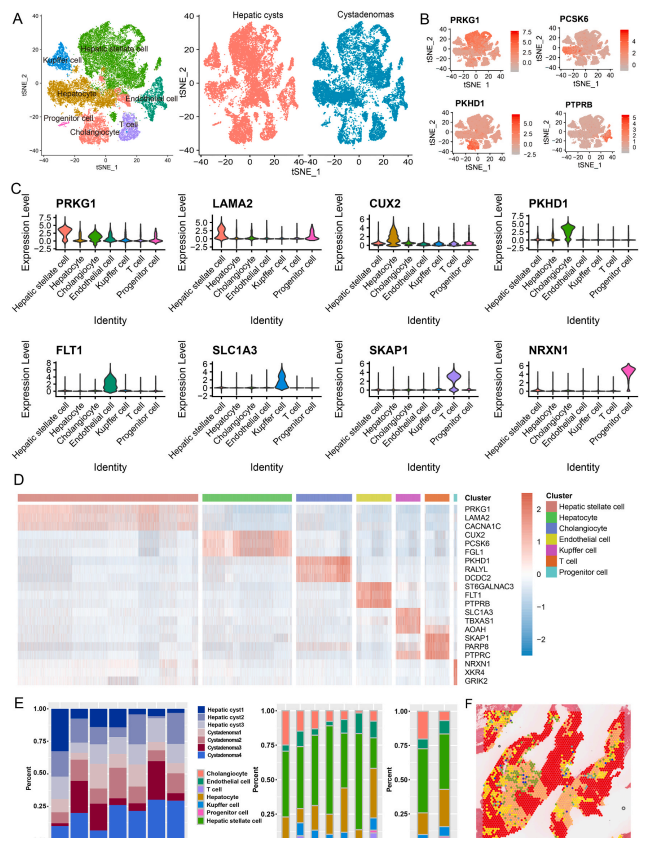
本研究通过单细胞核转录组测序探索了肝囊肿和囊腺瘤的细胞组成差异,以此来分析两者的肿瘤微环境。基于tSNE (t-distributed stochastic neighbor embedding)分析的结果,通过降维聚类核已知的细胞标志物,研究从中发现了7类细胞。肝囊肿和囊腺瘤的样本中均包含了这7类细胞。从数据中还可发现:(1)肝囊肿细胞中高表达PRKG1,LAMA2,CACNA1C(2)肝实质细胞高表达CUX2,PCSK和FGL1(3)胆管上皮细胞高表达PKHD1,RALYL和DCDC2(4)内皮细胞特异性表达ST6GALNAC3,FLT1和PTPRB(5)T细胞高表达SKAP1,PARP8和PTPRC(6)库普弗细胞表达SLC1A3,TBXAS1和AOAH(7)祖细胞特异性表达NRXN1,XKR4和GRIK2。
虽然肝囊肿和囊腺瘤的样本都有这7类细胞,但是细胞类型的占比上却有显著性差异。肝囊肿组织中有更多的胆管细胞和肝星状细胞,囊腺瘤组织中则有更多内皮细胞,肝实质细胞,库普弗细胞,T细胞和祖细胞。囊腺瘤中更多的T细胞说明了其相比肝囊肿,有着更强的免疫浸润。为了验证单细胞核测序的结果,研究还使用了空间转录组的技术进行检测,最后也得到了相似的结论。这说明了肝囊肿和囊腺瘤。
2. 囊腺瘤中的肝星状细胞比肝囊肿中的更为恶性
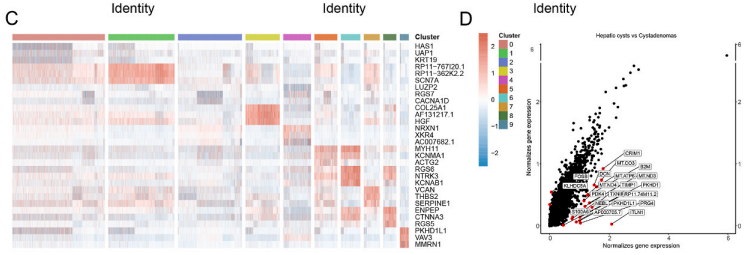
肝星状细胞(HSC)是纤维化的肝中的主要细胞类型。在肝脏受到损伤时,肝星状细胞会进入激活状态,进而成为生成肝损伤时细胞外基质的主要来源。这也让它成为肝病理学的的一个关键指标。研究发现,囊腺瘤和肝囊肿的组织中都有大量的肝星状细胞。进一步对这些肝星状细胞进行聚类分析,可以从中发现10个簇。而这10个簇在两种病中的分布却有明显区别。在肝囊肿中,可以发现含PKHD1变异的簇,也有高表达PRG4和PDK4的簇。PKHD1变异已被确认会诱发严重多囊肝。PRG4则被发现和肝细胞癌患者预后有关,并会抑制癌细胞的转移。PDK4调节的糖酵解可以从铁死亡中保护肝星状细胞。在囊腺瘤中,FOSB显著高表达。FOSB是肝细胞癌诊断和预后的重要标志物。
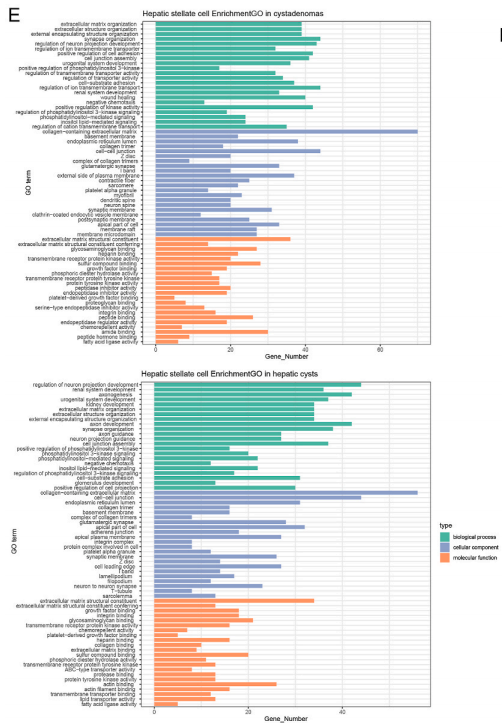
为了分析肝星状细胞在两种疾病中功能上的差异,他们又根据标志物分别对两种疾病样本中肝星状细胞的基因进行了功能富集。结果显示,在两种疾病中,都富集到了和细胞外基质产生,复合结合相关基因。在肝囊肿组织中,还特异性地富集到了和细胞贴壁和抑制酶活相关的功能的基因。而细胞贴壁在癌症进程中有着关键作用,它会促发包括免疫逃逸和转移扩散的癌症性状。在囊腺瘤组织中,则富集到了蛋白结合和跨膜转运相关的基因。跨膜转运被认为在癌症的发展和癌症治疗中的抗药性中起到作用。
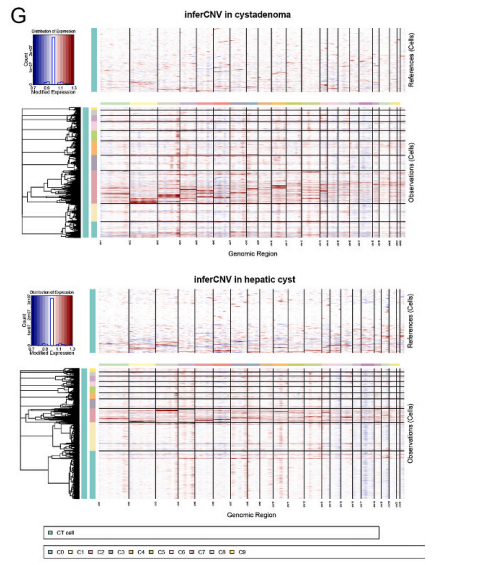
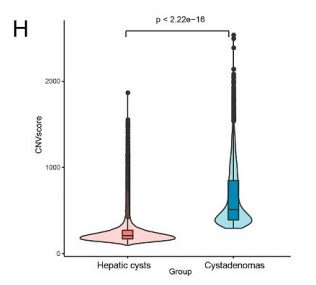
实验还分析了两种疾病中的肝星状细胞的单细胞拷贝数变异(CNV)。由此发现两种疾病组织中的肝星状细胞在染色体2,3,4,10上存在显著的拷贝数变异,而且囊腺瘤组织中的拷贝数变异要显著高于肝囊肿组织中的。这说明囊腺瘤中的肝星状细胞比肝囊肿中的更为恶性。
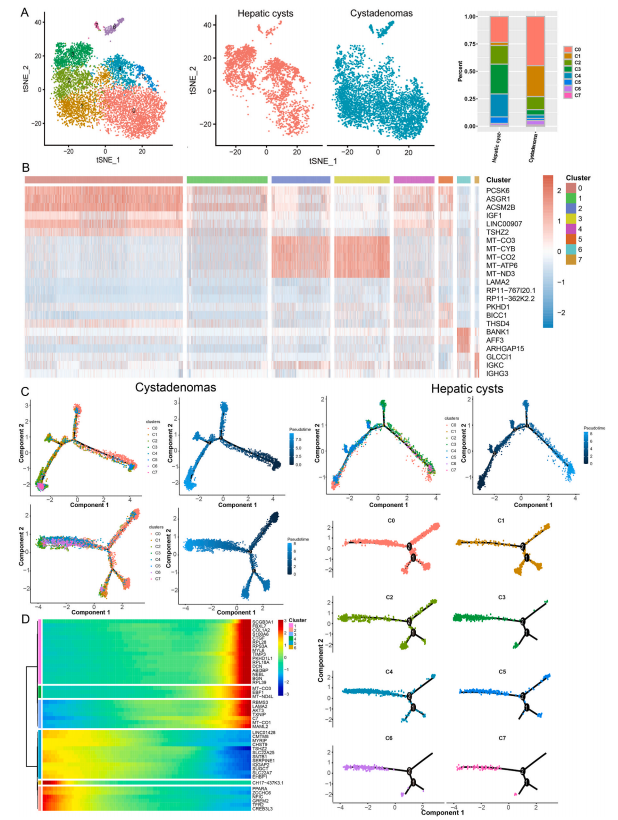
3. 细胞轨迹分析揭示了肝实质细胞在囊腺瘤和肝囊肿中的动态变化
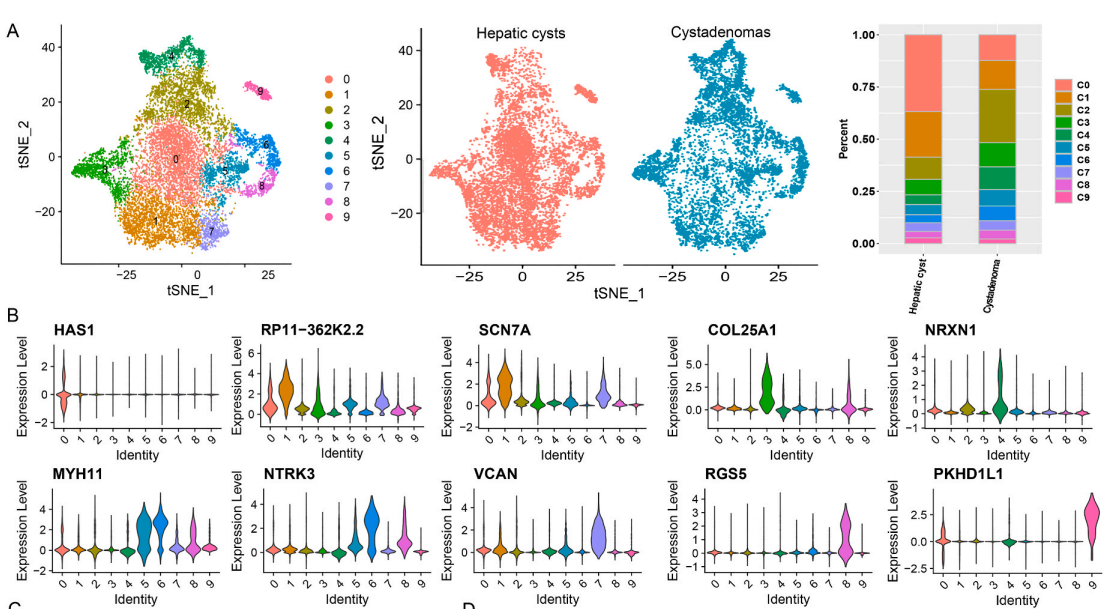
肝实质细胞是肝组织中的占接近80%体积的实质细胞亚簇。根据t-SNE算法,可以分出8类肝实质细胞簇,而其中的簇3,4主要存在于肝囊肿组织中,簇1主要在囊腺瘤组织中。通过对基因表达模式的分析,可以发现簇3,4有着相似的表达模式。
另外,研究也通过Monocle2,对两类疾病中的肝实质细胞进行了细胞轨迹分析,进而发现了两种疾病中肝实质细胞分化模式上的区别。肝囊肿中的肝实质细胞有7种状态,包括了3种初始分支,和4种其它分支。其中,亚簇4,5主要在出现在分化的初期,而亚簇2,3则是在分化的末期。囊腺瘤种的肝实质细胞则有5种状态,包括了2种初始分支,和3种其它分支。其中,亚簇0主要在出现在分化的初期,而亚簇1,6,7则是在分化的末期。除此之外,研究者也对两组数据进行了混合分析。由此可以得到5种状态的肝实质细胞,包括2个初始分支和3个其它分支。其中,来自肝囊肿的亚簇2,主要存在于分化的初期,而来自囊腺瘤的亚簇6,7则租户要存在于分化末期。与此同时,在分化不同阶段,表达量存在显著差异的基因,随着分化增多或是减少的基因也被一同分析得出。结合已有文章中对这些基因功能的研究,可以发现肝囊肿中的肝实质细胞,存在向囊腺瘤中肝实质细胞演化的趋势。这些实验结果表明了肝实质细胞在这两种疾病中的动态转化过程。
4. T细胞的转录组分析揭示了囊腺瘤和肝囊肿中不同的转录调节机制
T细胞是肿瘤免疫治疗中的重要元素,其在细胞组成上的高度异质,表达模式和功能特征会显著影响免疫治疗的效果。在囊腺瘤和肝囊肿这两类组织中,研究鉴定出了2047个T细胞。通过t-SNE,可以将这些T细胞分成5个簇。两类疾病组织中,都可以发现这5类T细胞,但是比例却明显不同。例如0亚簇的T细胞在肝囊肿中的比例显著高于囊腺瘤中的,1亚簇的情况则相反。通过差异表达分析可以发现,可以发现不同簇中表达模式上的差异。功能富集的结果也表明不同簇存在高度的功能异质性。亚簇0的T细胞主要和新陈代谢有关,细胞处于激增和激活的状态。亚簇2主要和T细胞受体(TCR)信号通路有关。亚簇4则和FcγR调控的吞噬作用有关。这表明,囊腺瘤和肝囊肿中部分T细胞的免疫功能,可能通过FcγR调控的吞噬作用来实现。
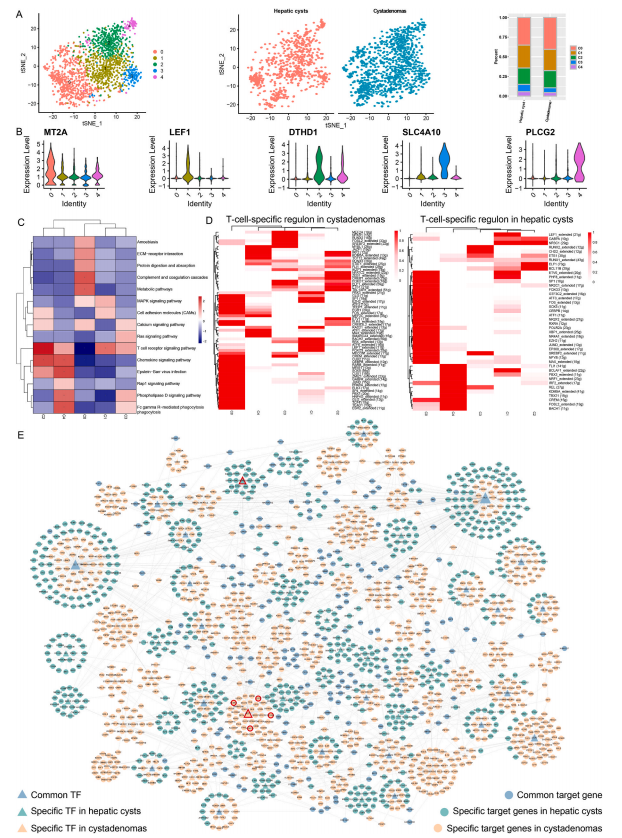
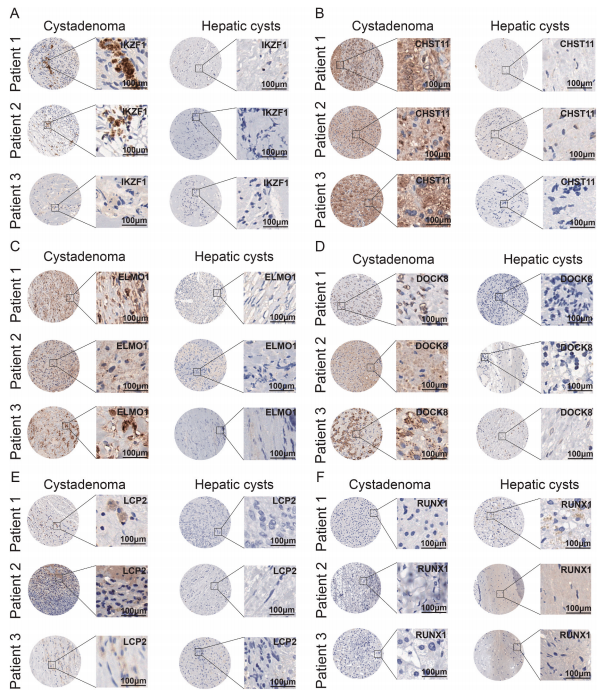
另外,研究使用SCENIC分别鉴定了囊腺瘤和肝囊肿中每个T细胞簇的特异性调节因子。结果显示,两种疾病中T细胞簇特异性调节因子存在差异。因此,通过进一步构建肝囊肿和囊腺瘤的转录调控网络,深入探讨了囊腺瘤和肝囊肿的转录调控机制。结果发现囊腺瘤和肝囊肿中不仅存在常见的转录因子和靶基因,而且存在两种疾病的特异性转录因子和特异性靶基因。其中,调节靶基因数量最多的转录因子是FLI1,它广泛调节囊腺瘤和肝囊肿中的多个靶基因。已有研究表明,FLI1可以通过调节趋化因子和细胞因子来影响免疫细胞的功能,也参与免疫细胞的发育、增殖、激活和迁移。此外,IKZF1仅在囊腺瘤中被发现,并且功能增强的IKZF1变体已被证明会导致与人类异常T细胞分化后期相关的免疫失调。在哈尔滨医科大学第一附属医院的一组囊腺瘤患者(n=3)中,通过免疫组织化学(IHC)的方法,进一步证实了IKZF1蛋白在囊腺瘤组织中的表达,而肝囊肿中则没有。此外,我们还鉴定了一些在囊腺瘤中特异性调控的靶基因,包括CHST11、ELMO1、DOCK8和LCP2等。IHC结果也显示,这些基因在囊腺癌中有阳性信号,但在肝囊肿组织中没有阳性信号。相反,RUNX1仅在囊腺瘤中发现。RUNX1可以直接或间接调节癌症增殖、血管生成、转移,增加癌症细胞干度和抗癌药物耐药性。同样,IHC结果也证实了RUNX1在肝囊肿组织(n=3)中的特异性表达。上述结果表明,T细胞在囊腺瘤和肝囊肿中具有不同的调节机制,且囊腺瘤具有比肝囊肿更复杂的免疫微环境。
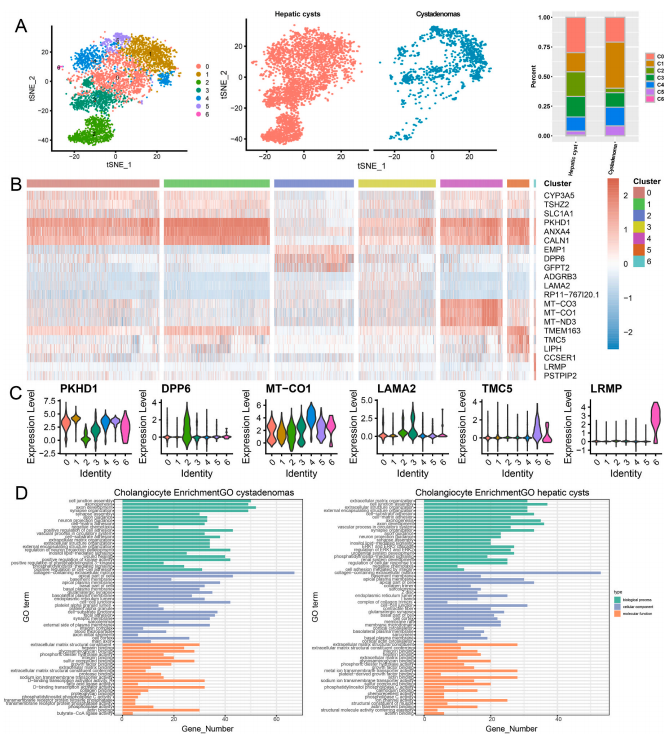
5. 囊腺瘤和肝囊肿中胆管细胞的差异性
胆管细胞是胆管的上皮细胞,呈柱状,在肝门附近的大胆管和肝外胆管中分泌HCO3,通过运输胆汁酸来促进肝细胞的存活。研究者借由t-SNE法鉴定了7个胆管细胞亚簇。囊腺瘤和肝囊肿均包含所有7个亚簇,但同样的,不同亚簇的占比并不相同。同时,研究也分析了一系列的特征基因在每个胆管细胞簇中的表达情况。其中,亚簇1、2、5和6均高表达Adnexin A4(ANXA4)基因。研究表明,Anxa4在癌症的诊断、预后和治疗中起着重要作用。簇5特异性高表达TMC5,据报道,TMC5也是与肝细胞癌诊断和预后相关的关键基因。簇6高表达PSTPIP2。文献证实,PSTPIP2的甲基化通过调节STAT1和NF-κB途径增强酒精诱导的肝损伤中的炎症。
随后,研究又对肝囊肿和囊腺瘤中差异表达的胆管细胞标记基因进行了功能富集。胆管细胞的标志物在肝囊肿中特异性富集到了与ERK1和ERK2相关的功能的基因。ERK1和ERK2是蛋白质丝氨酸/苏氨酸激酶,参与Ras-Raf MEK-ERK信号转导级联。该级联参与调节多种过程,包括细胞粘附、细胞周期、迁移、存活、分化、代谢、增殖和转录。另外,在囊腺瘤中,则富集到了磷脂酰肌醇3−激酶的正调控相关基因。磷脂酰肌醇3-激酶是进化过程中生长因子信号传导的关键因素,也在许多生理过程中发挥着重要作用,包括胰岛素信号传导、细胞生长和免疫。有报道指出,肝囊肿中,存在胆管细胞起源的情况。这表明,胆管细胞可能通过ERK1和ERK2级联反应激活Ras-Raf MEK-ERK信号通路,从而调节细胞粘附和细胞增殖等过程,导致肝囊肿的形成和发展。在囊腺瘤中,胆管细胞通过PI3K信号通路参与囊腺瘤的进展,PI3K可能是囊腺瘤的标志,PI3K信号通路的靶向治疗可能抑制囊腺瘤的生长。
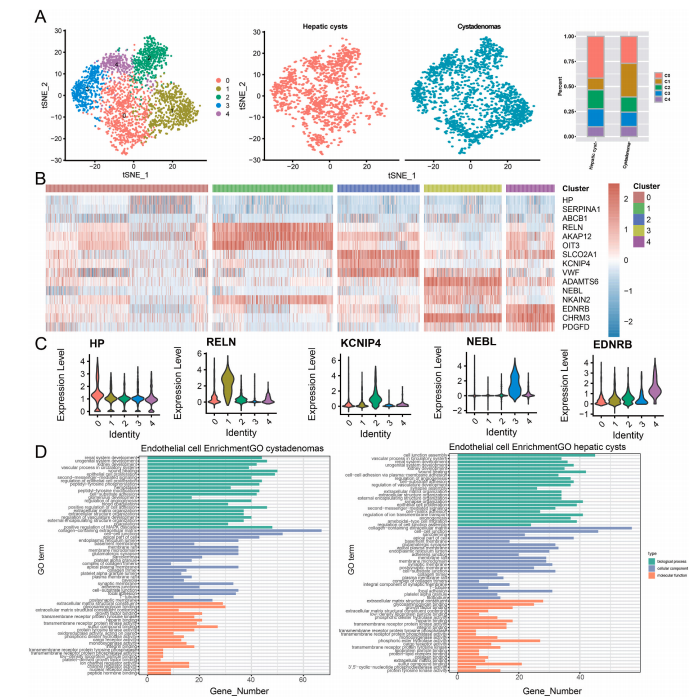
6. 囊腺瘤的内皮细胞迁移能力高于肝囊肿的
内皮细胞是人体内的单层鳞状上皮细胞,主要位于血管内壁。研究通过t-SNE对内皮细胞的进一步亚簇分析显示,内皮细胞被分为五个亚簇。同样,肝囊肿和囊腺瘤都含有来自所有五个亚簇的细胞,但比例不同。同时,也对每个内皮细胞亚群中特征基因的表达进行了分析。研究发现,簇0特异性表达内皮细胞的外排泵基因ABCB1。簇1特异性高表达可增加肝细胞癌的复发率的RELN。簇2高度表达与肝硬化高凝状态相关的VWF基因。在差异表达内皮细胞标志物的功能富集中,研究发现MAPK级联相关功能基因在囊腺瘤中得到特异性富集。而MAPK级联的异常调节可以影响在肿瘤发生中起重要作用的关键信号元件。同时,也特异性富集到与细胞粘附的正调控相关途径的基因。细胞粘附介导内皮细胞的渗透屏障,将血流与下方器官和组织分离,并控制液体、溶质和细胞沿血管壁的输运。这表明囊腺瘤中的内皮细胞比肝囊肿具有更高的迁移能力和更高的恶性风险。
 本文的单细胞核测序分析展现了病变组织中囊腺瘤和肝囊肿细胞的肿瘤内异质性及其肿瘤微环境,阐明了囊腺瘤和肝脏囊肿微环境之间的差异。而在囊腺瘤和肝囊肿病变中,也鉴定出不同细胞类型的不同簇和亚簇,并确定了它们相应的分子特征。拷贝数变异显示囊腺瘤和肝囊肿中肝星状细胞的恶性程度不同。囊腺瘤和肝囊肿的肝细胞分化模式也通过单细胞核测序数据分析得出。此外,T细胞的组成及其性质表明,囊腺瘤具有更高的免疫浸润性和更复杂的免疫调节机制。这项研究为囊腺瘤和肝囊肿提供了初步的细胞图谱,并为后续分子水平研究奠定了基础。
本文的单细胞核测序分析展现了病变组织中囊腺瘤和肝囊肿细胞的肿瘤内异质性及其肿瘤微环境,阐明了囊腺瘤和肝脏囊肿微环境之间的差异。而在囊腺瘤和肝囊肿病变中,也鉴定出不同细胞类型的不同簇和亚簇,并确定了它们相应的分子特征。拷贝数变异显示囊腺瘤和肝囊肿中肝星状细胞的恶性程度不同。囊腺瘤和肝囊肿的肝细胞分化模式也通过单细胞核测序数据分析得出。此外,T细胞的组成及其性质表明,囊腺瘤具有更高的免疫浸润性和更复杂的免疫调节机制。这项研究为囊腺瘤和肝囊肿提供了初步的细胞图谱,并为后续分子水平研究奠定了基础。
原文链接
https://www.sciencedirect.com/science/article/abs/pii/S0010482524006255
关于本研究中使用的
snRNA-seq研究方法
单细胞核测序(Single-Nucleus RNA Sequencing, snRNA-seq)和单细胞测序(Single-Cell RNA Sequencing, scRNA-seq)都是用于解析细胞异质性的重要技术。而相比于常规的单细胞测序,单细胞核测序主要具有有以下特点和优势:
1. 样本要求低:snRNA-seq可以从冷冻组织中提取核酸,而不需要新鲜样本,这使得它在处理难以获取的新鲜样品或长期保存的组织样品时具有显著优势。
2. 减少技术误差:单细胞核测序主要分析的是细胞核中的RNA,避免了细胞质RNA提取过程中可能引入的技术误差。
3. 处理复杂组织:snRNA-seq在处理复杂或坚韧的组织时,能够更有效地分离细胞核,减少机械损伤和细胞死亡。
4. 捕获特定细胞类型:对于一些难以分离的细胞类型或处于某些状态的细胞,细胞核的分离和测序更为适用,避免了解离偏好性。
5. 避免细胞应激反应:在单细胞分离过程中,细胞质RNA可能因解离细胞应激反应而发生变化,而细胞核RNA相对稳定,减少了应激反应的影响。
而通过本研究,也可以看到snRNA-seq在癌症研究中的应用前景:
1.肿瘤异质性分析:snRNA-seq能够深入解析肿瘤内部的细胞异质性,包括识别不同的癌细胞亚群和肿瘤微环境中的免疫细胞、基质细胞等。
2. 肿瘤进化和耐药性研究:通过分析癌症组织中不同细胞核的基因表达谱,可以追踪肿瘤进化过程,了解癌细胞如何发展耐药性,为个性化治疗提供依据。
3. 微环境研究:snRNA-seq可以分离并分析肿瘤微环境中的细胞核,揭示肿瘤与其微环境之间的相互作用,了解免疫逃逸机制。
4. 转移研究:通过比较原发肿瘤和转移灶的细胞核RNA表达谱,研究肿瘤转移的分子机制,发现潜在的治疗靶点。
而该研究所使用的伯优®细胞核分离试剂盒是由伯豪生物独立研究开发的产品。
产品优势:最大限度地维持细胞核膜的完整和染色质的空间结构稳定性得率高,杂质少,不易成团。
产品应用:表观遗传学研究(如scATAC- seq/bulk ATAC- seq,CUT&Tag);核转录组测序(snRNA-seq/bulk RNA-seq)等。
结果参考

产品列表

更多相关信息和产品欢迎
联系我们获取
