外泌体到底有多神秘?看了就知道答案了!
产品名称: 外泌体到底有多神秘?看了就知道答案了!
英文名称: 外泌体
产品编号:
产品价格: 2000-10000
产品产地: null
品牌商标: null
更新时间: null
使用范围: null
- 联系人 :
- 地址 : 上海市浦东新区国际医学园区紫萍路908弄19号楼
- 邮编 : 201321
- 所在区域 : 上海
- 电话 : 158****3038 点击查看
- 传真 : 点击查看
- 邮箱 : oobio@obiosh.com
外泌体(Exosomes)作为当前科研界的热度话题,很多人觉得它很神秘,不知道它在疾病治疗或发生、发展中扮演什么样的角色,今天我们跟大家一起基于文献来探讨一下外泌体具有的功能。
先回顾一下外泌体的基础知识。外泌体是细胞分泌到胞外的一种囊泡(Extracellular Vesicles,EVs),其大小为30-150nm,具有双层膜结构和茶托状形态,含有丰富的内含物(包括核酸、蛋白和脂质等),参与细胞间的分子传递。所有的细胞都能分泌外泌体,但是不同细胞分泌的外泌体不管在数量上还是在内含物中都具有很大的差异性,这也决定了每种外泌体所行使的功能不一样。

肿瘤细胞来源外泌体功能解析:
- 海军军医大学王红阳课题组在《Nature Communications》上发表文章[1],揭示了肝癌细胞分泌的外泌体可促进正常成纤维细胞向癌症相关成纤维细胞(CAFs)转化,其中起重要作用的是外泌体中的miR-1247-3p。CAFs能分泌促炎因子,并促进肝癌的发展和向肺部的转移。
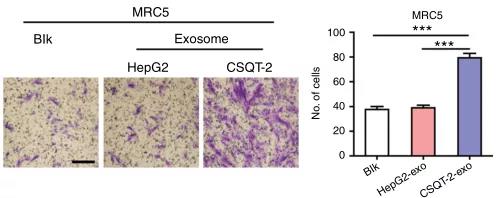
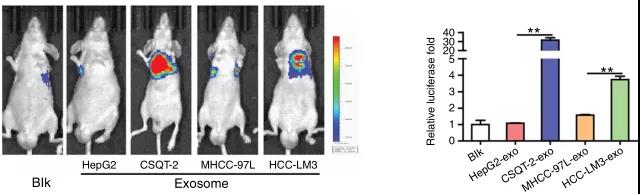
图三 肝癌细胞分泌的外泌体促进肺部转移
- 大连医科大学宋波课题组和关宏伟课题组等在《Cancer Letters》上发表文章[2],阐述了阿霉素耐药的胃癌细胞可以通过外泌体向不耐药的胃癌细胞传递miR-501,引起胃癌细胞中BLID基因下调和使下游caspase通路失活,从而促进胃癌细胞增殖、迁移和侵袭,同时抑制细胞凋亡和增强胃癌细胞的耐药性。
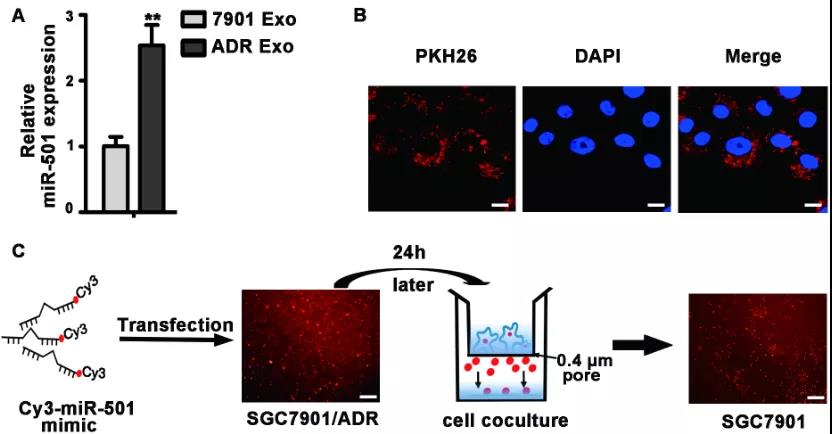
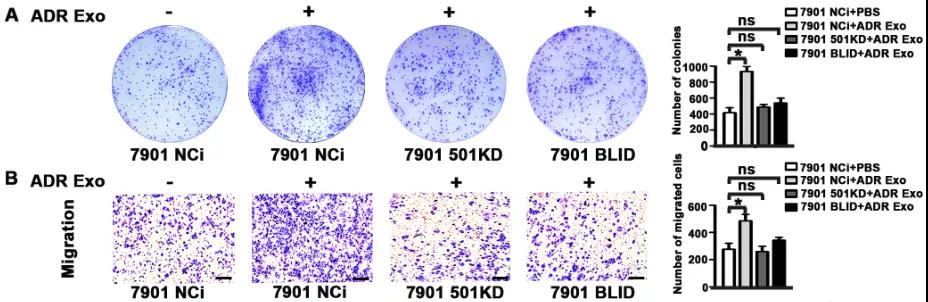
神经系统细胞来源外泌体的功能阐述:
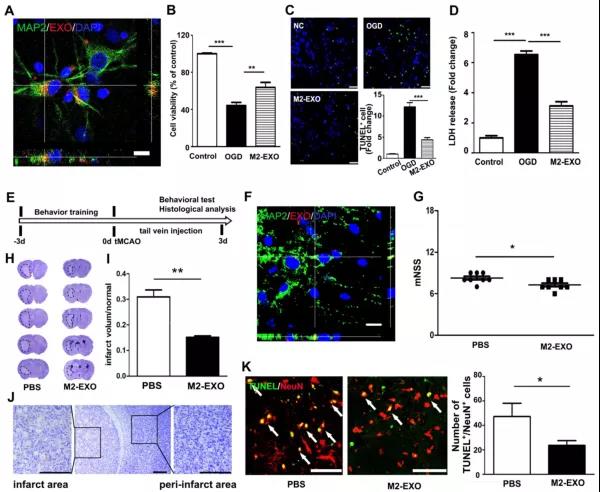
- 上海交通大学医学院附属瑞金医院神经科、Med-X研究院神经科学与神经工程中心的杨国源课题组在《Theranostics》杂志上发表了重要工作[3],文中阐述M2型小胶质细胞BV2来源的外泌体(M2-EXO)通过将外泌体中miR-124转移到神经元并调控其下游基因USP14表达,从而促进神经细胞存活和减弱缺血性脑损伤,对缺血小鼠的大脑发挥神经保护作用。
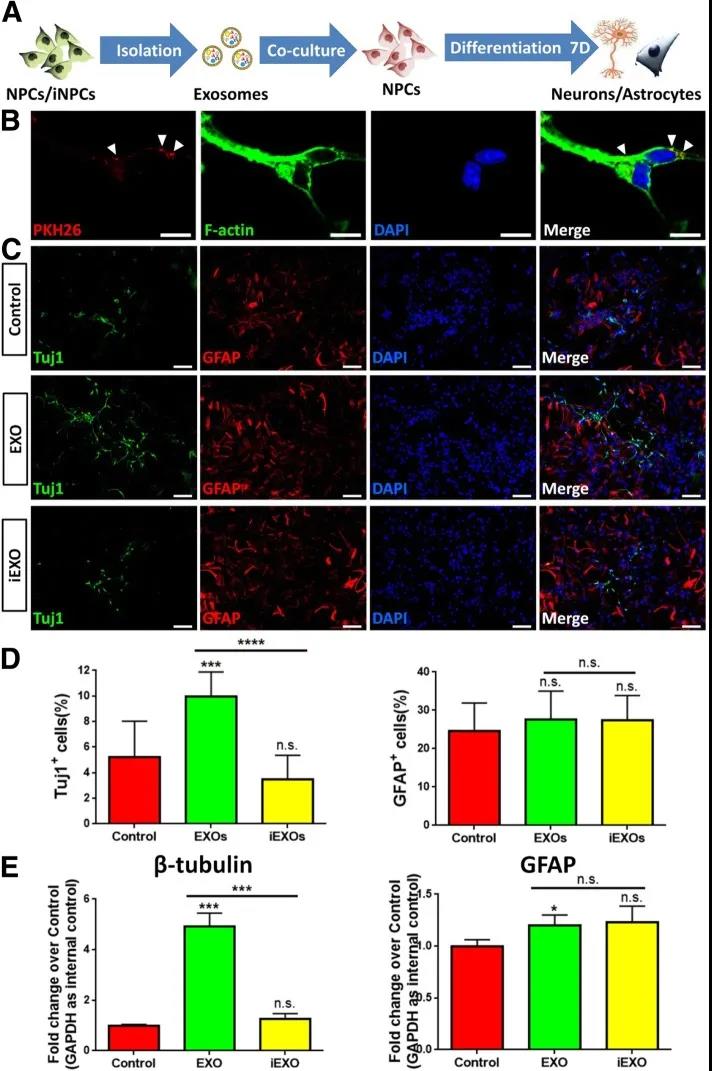
- 同济大学和美国内布拉斯加大学医学中心联合在《Cell Communication and Signaling》杂志上发表了重要工作[4],文中揭示了神经干/祖细胞(NPCs)和诱导神经干/祖细胞(iNPCs)来源的外泌体(分别为EXOs和iEXOs)对神经元分化的影响,通过microarray分析发现miR-21a在EXOs和iEXOs中显著差异表达,且miR-21a作为神经胶质细胞生成的新型调节因子,可介导外泌体的神经发生潜能,这为神经系统疾病无细胞治疗策略的发展提供了思路。
干细胞来源外泌体的功能分析:
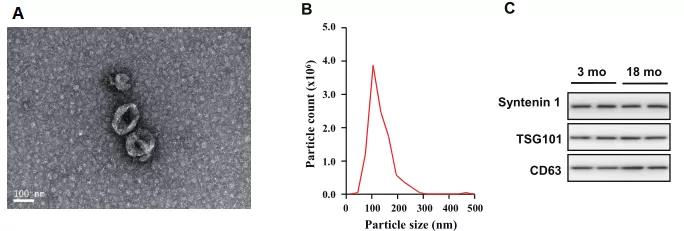
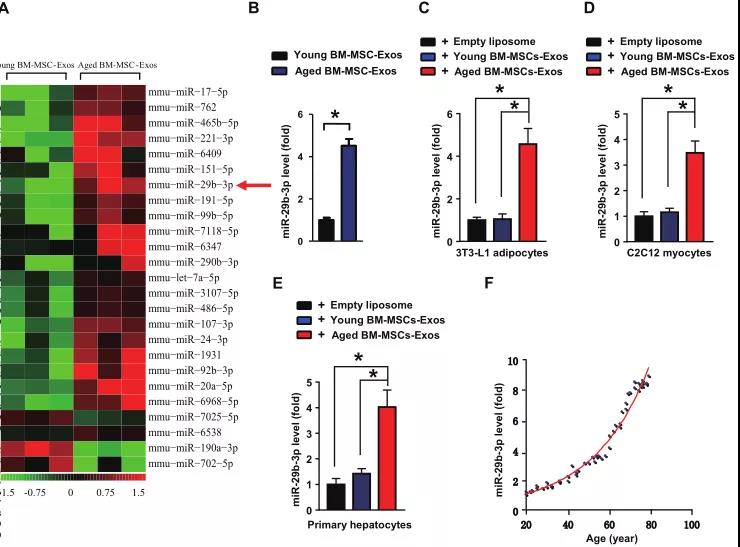
- 中南大学湘雅医院罗湘杭课题组在《ACS Nano》上发表研究,发现年老小鼠的骨髓间充质干细胞(BM-MSCs)分泌的外泌体中miR-29b-3p含量显著增高,其下游靶基因SIRT1的表达水平明显下降。miR-29b-3p可调节衰老相关的胰岛素抗性,可能将会成为与衰老相关胰岛素抗性的潜在治疗靶点。
- 南京医科大学第一附属医院蔡卫华课题组在《Acta Biomaterialia》上发表文章,阐述了缺氧处理下间充质干细胞(MSCs)来源的外泌体(Hypo-Exos)比常氧下的外泌体(Exos)可进一步增强血管生成、增殖和迁移。此外,文中揭示了缺氧预处理通过激活HIF-1α介导了外泌体miR-126的产生,从而促进骨折的愈合。
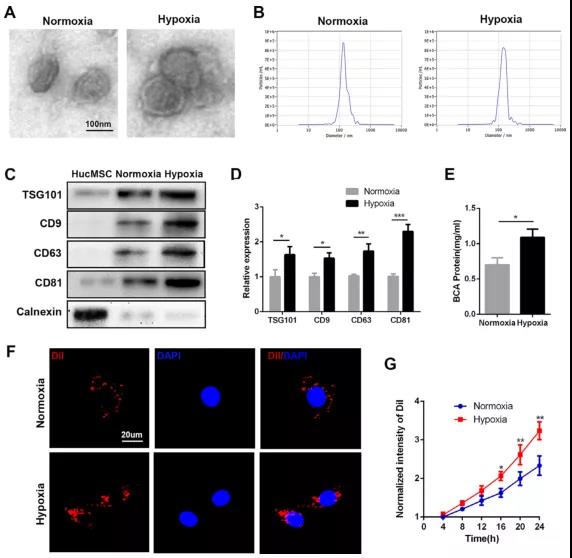
综上所述,外泌体既可以促进肿瘤细胞增殖、迁移和侵袭,抑制肿瘤细胞凋亡,实现肿瘤的发展、转移和耐药,也可以增强神经元存活、血管生成等,从而作为神经系统疾病、代谢系统疾病的治疗手段。外泌体功能取决于分泌外泌体的细胞类型,看它是由肿瘤细胞分泌的?还是干细胞分泌的?还是巨噬细胞分泌的?等,外泌体来源不同,其功能差异也巨大。外泌体的应用除了上述的疾病治疗外,还包括液体活检中的诊断标志物和天然的药物载体两个方向,后面我们会继续讨论这方面的研究进展。
参考文献:
[1] Nat Commun.2018 Jan 15;9(1):191. doi:10.1038/s41467-017-02583-0.
[2] Cancer Lett. 2019 Sep 10;459:122-134.doi:10.1016/j.canlet.2019.05.035. Epub 2019 Jun 5.
[3] Theranostics. 2019 May 4;9(10):2910-2923.doi: 10.7150/thno.30879. eCollection 2019.
[4] Cell Commun Signal. 2019 Aug 16;17(1):96.doi: 10.1186/s12964-019-0418-3.
[5] ACS Nano. 2019 Feb 26;13(2):2450-2462.doi: 10.1021/acsnano.8b09375. Epub 2019 Feb.
[6] Acta Biomater. 2020 Feb;103:196-212. doi: 10.1016/j.actbio.2019.12.020. Epub 2019 Dec 17.
和元生物一直致力为外泌体研究提供整体解决方案,从实验设计、外泌体分离、外泌体鉴定、外泌体分子检测到外泌体示踪和体内外功能验证,丰富的项目经验、专业的科研团队、优质的技术支持服务,为您的项目保驾护航!

