药物载体|人工改造的外泌体传递miRNA和化疗药物逆转了肿瘤的耐药性
产品名称: 药物载体|人工改造的外泌体传递miRNA和化疗药物逆转了肿瘤的耐药性
英文名称: 外泌体
产品编号:
产品价格: 2000-10000
产品产地: null
品牌商标: null
更新时间: null
使用范围: null
- 联系人 :
- 地址 : 上海市浦东新区国际医学园区紫萍路908弄19号楼
- 邮编 : 201321
- 所在区域 : 上海
- 电话 : 158****3038 点击查看
- 传真 : 点击查看
- 邮箱 : oobio@obiosh.com
结直肠癌(CRC)是世界范围内第三大致死癌症,由于其侵袭性强、预后差和缺乏靶向治疗,因此发病率较高。基于5-氟尿嘧啶(5-FU)的化疗在CRC的治疗中起了重要作用。然而,由于长期使用5-FU会产生多药耐药性(MDR),从而严重削弱了治疗效果[1, 2]。
最近,科学家们发现癌症耐药株中miRNA在耐药性方面起了重要作用,且药物抗性的分子靶点和机制也被阐明[3, 4],如miR-21可通过下调CRC中人类DNA MutS homolog2(hMSH2)诱导对5-FU的耐药性[5]。文献进一步报道,恢复失调的miRNAs可以有效克服耐药性。因此,作者推测共传递MDR-reversing miRNA和化学治疗药物将是一种有望克服癌症化疗中MDR的有效方法。但是,安全有效的靶向给药系统是CRC治疗的关键。
外泌体(exosomes)是由多泡体(MVB)与质膜融合时释放到细胞外环境的一种膜泡[6],在不同细胞的外泌体中都可以检测到mRNAs、miRNAs和蛋白质的存在,以此挖掘外泌体介导细胞间通讯的潜在机制。文献报道了外泌体可以有效地传递生物药物,且通过分子途径可以靶向识别肿瘤细胞,实现精准药物递送[7]。但是利用外泌体进行功能RNAs和化疗药物共递送尚未被分析透彻,还需要进一步研究。
近期东南大学肖忠党课题组通过对外泌体进行改造,同时用外泌体共递送5-FU和miR-21抑制剂(miR-21i)靶向结肠癌细胞,经体外和体内研究表明了用工程化外泌体递送5-FU和miR-21i可有效逆转耐药性,并显著增强了5-FU耐药癌细胞的毒性[8]。
和元生物可提供从实验设计、外泌体分离、外泌体鉴定、外泌体高通量检测、外泌体示踪到体内外功能验证的整体服务。
实验结果:
1.外泌体的分离和表征
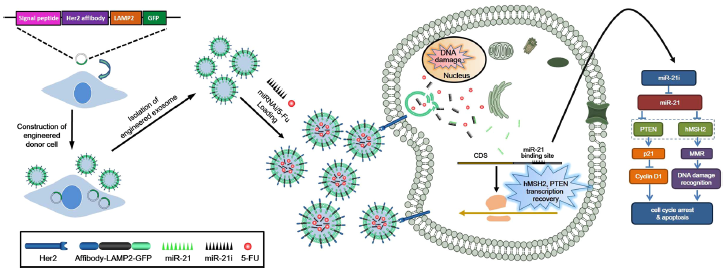
为了使外泌体具有靶向性,作者将Her2亲合体与人Lamp2的胞外N端融合,根据以前的研究,Lamp2蛋白在外泌体膜中被大量发现。再将该融合结构克隆到带有GFP的慢病毒载体中,形成了THLG,另外一种不含Her2亲合体的融合结构,克隆后形成了LG,作为对照(Fig.1a)。随后将THLG和LG转染到HEK293T中,THLG-293T或LG-293T细胞的荧光显微镜图片显示,THLG和LG嵌合体蛋白存在于颗粒膜和质膜中(Fig.1b)。从THLG-293T或LG-293T的培养上清中分别超离出外泌体(THLG-EXO 和LG-EXO),再用western对外泌体的标志物如CD63、CD9、CD81进行检测(Fig.1c)。为了验证LAMP2融合蛋白是否结合到来自母细胞的外泌体中,作者用anti-GFP抗体和WB检测了融合蛋白在母细胞和外泌体中的表达。如Fig.1c所示,融合蛋白(LG)的分子量大约在80kDa,而THLG融合蛋白略高于LG,这与糖基化LAMP2和GFP的分子大小之和一致。此外,结果显示LG和THLG在HEK293T中均有高表达,并能整合到外泌体中。相比之下,在转染GFP的HEK293T细胞的外泌体中没有检测到GFP的水平,说明细胞质中的GFP可能没有整合到外泌体(Fig.1d)。此外,上述结果证明了含有GFP的融合蛋白存在于外泌体中,并对THLG-EXO和LG-EXO进行检测,结果显示可以在激光扫描共聚焦纤维镜下观察到GFP。这一结果进一步表明了融合蛋白成功地整合到外泌体中(Fig.1e)。
然后利用透射电镜(TEM)和动态激光散射光谱(DLS)对外泌体的形态和大小进行了评价。其中,THLG-EXO具有典型的碟状双层膜结构,直径为60-130nm(Fig.1f)。DLS结果显示外泌体的大小分布较窄,平均直径为97nm,而THLG-EXO在装载了5-Fu/miR-21i后大小为110nm(Fig.1g)。
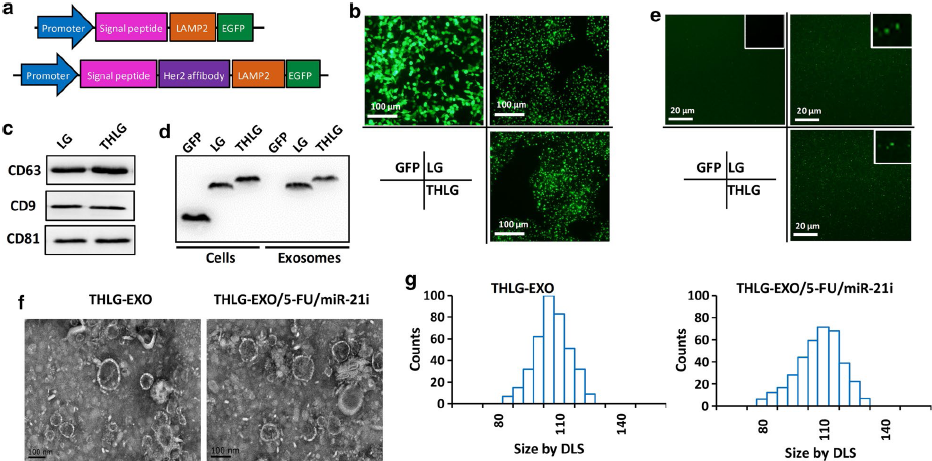
Fig.1 工程化外泌体的分离和分子特征
2.含miR‑21i和5‑FU外泌体的制备
接下来,作者评估了THLG-EXO作为共递送5-FU和miR‑21i的载体的可行性。之前的一些结果表明,使用电穿孔可以有效地将化疗药物和外源短RNAs引入EVs。在本次研究中,作者也使用了电穿孔的方法将miR‑21i和5‑FU装载入外泌体中。为了获得最佳的电穿孔参数,作者测试了不同的电压和脉冲长度对电穿孔效率的影响。结果表明,当时间常数为10ms,电压为1000V时,装载效率最高。电穿孔后,THLG-EXO/5-FU/miR-21i的体积在miR-21i和5-FU负载的外泌体的形态上显示出一些细微的差异,包括略大的平均直径(110±11.3nm)(Fig. 1f, g)和表面电位 (11±2.7mV)。而TEM照片显示THLG-EXO的平均直径为97±6.2 nm,表面电位为−8±2.4 mV。关于这些变化,作者推测这是在外泌体中电穿孔miR-21i和5-FU的结果,因为所有用于产生外泌体的其他程序都是相同的。在最佳电穿孔条件下,HPLC和qRT-PCR结果表明,外泌体的5-FU和miR-21i负载量(LC)分别约为3.1%和0.5%。
3.THLG-EXO的体外靶向性
为了分析THLG-EXO在体外的潜在靶向能力,作者建立了Her2阴性的SGC-7901 WT细胞和Her阳性的Her2-mcherry-SGC-7901细胞共培养模型并进行了评价(Fig. 2a)。荧光显微镜结果显示,与SGC-7901 WT细胞相比,THLG-EXO与Her2-mcherry-SGC-7901细胞共培养3h后,THLG-EXO能更有效地进入Her2-mcherry-SGC-7901细胞。相比之下,LG-EXO在Her2-mcherry-SGC-7901细胞中没有表现出这种特异性的定位,且在共培养模型中随机分布(Fig. 2b)。此外,利用流式细胞仪定量分析了THLG-EXO的细胞摄取情况。图Fig. 2c所示,与THLG-EXO共培养3h后,GFP阳性的Her2-mcherry-SGC-7901细胞增加了92.9%,而SGC-7901细胞则为18.6%,差异具有统计学意义(p<0.01)。相比之下,与LG-EXO共培养3h后,GFP阳性的Her2-mcherry-SGC-7901细胞百分比仅增长了1.4%,而SGC-7901细胞比例为1.2%。这些结果表明使用T-Her2作为Her2的配体可以显著地增强外泌体靶向细胞的能力。
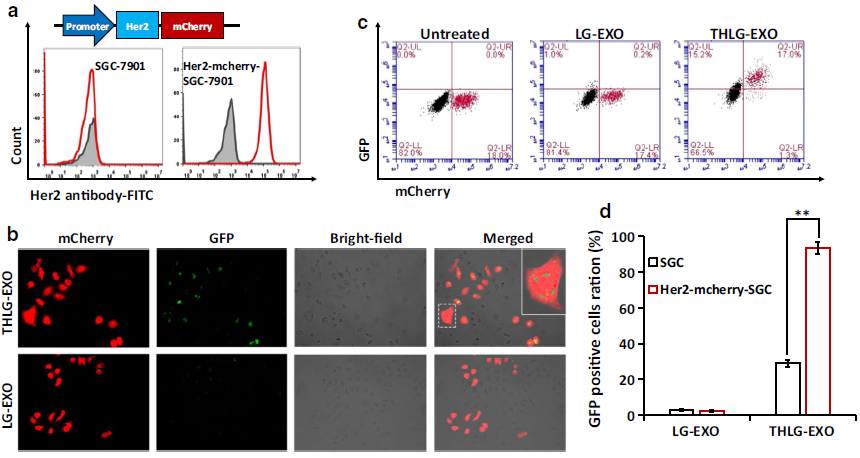
Fig.2THLG-EXO在体外的细胞趋向性
4.THLG‑EXO/5‑FU/miR‑21i的体外抗肿瘤作用
上述结果表明,工程化外泌体能有效地被受体细胞吸收。随后,作者研究了包裹了miR-21i和5-FU的THLG‑EXO诱导的生物学效应以及miR-21i和5-FU对5-FU耐药的结肠癌细胞系的协同细胞毒性。HCT-116的5-FU耐药株是在5-FU浓度逐渐增加的情况下,由这些细胞连续传代产生的。首先,作者研究了THLG‑EXO/5‑FU/miR‑21i传递寡核苷酸进入靶细胞的能力。如Fig.3a所示,HCT-1165FR与THLG‑EXO/miR‑21i共孵育6h后,其内源性miR-21水平显著降低,而与游离的miR‑21i共孵育后并没有出现这种情况,说明与游离的miR-21i共孵育后并没有寡核苷酸进入HCT-1165FR细胞。为了进一步证实THLG‑EXO/5‑FU/miR‑21i中miR‑21i在HCT-1165FR细胞中诱导的生物学功能,作者评估了miR-21下游靶基因的表达水平,如hMSH2和PTEN。如所预期的,与THLG-EXO处理的细胞相比,HCT-1165FR细胞用THLG-EXO/5-FU/miR-21i处理后,hMSH2和PTEN的蛋白表达水平增加(Fig.3b)。这些结果表明THLG‑EXO/5‑FU/miR‑21i可以有效地将miR-21i传递到受体细胞的细胞质中,且能特异性地沉默受体细胞中miR-21的生物学功能。
接下来,为了评估THLG‑EXO介导的5-FU和miR-21i共递送的协同抗肿瘤效果,作者研究了5-FU浓度为5ug/ml时HCT-1165FR细胞的凋亡、细胞周期和增殖情况。如Fig.3c所示,与装载了miR-21i或5-FU的THLG‑EXO共孵育后,HCT-1165FR细胞的凋亡率分别达到12.6%和26.2%。显然,与mock-THLG-EXO处理组相比,只递送miR-21i并不能达到理想的治疗效果。相比之下,THLG-EXO介导的5-FU和miR-21i共递送引起的细胞凋亡率(凋亡率约42.3%)要高于THLG-EXO/5-FU处理的细胞组(凋亡率约26.2%),这说明了协同效果对靶细胞的凋亡影响最强。
随后,通过PI对细胞周期进行评估,结果显示,与THLG‑EXO相比,THLG‑EXO/5‑FU/miR‑21i对HCT-1165FR细胞的S期阻断显著,而THLG‑EXO/miR‑21i对HCT-1165FR细胞周期分布没有明显的影响(Fig.3d)。值得注意的是,与THLG‑EXO相比,THLG‑EXO/5‑FU/miR‑21i对HCT-1165FR细胞的G1期也有一定程度的影响,但是这种效果没有对S期明显。此外,作者还分析了THLG‑EXO/miR‑21i、THLG‑EXO/5‑FU、THLG‑EXO/5‑FU/miR‑21i抑制癌细胞增殖的能力。结果显示,这三种外泌体都可以抑制细胞的增殖,但是随时时间的推移,它们对细胞增殖的影响有明显的差异。如Fig.3e所示,与THLG‑EXO/miR‑21i、THLG‑EXO/5‑FU、THLG‑EXO/5‑FU/miR‑21i共培养6天后,细胞增殖分别被抑制了约12%、43%和82%。这个结果表明,虽然THLG‑EXO/5‑FU具有较强的抑制生长的作用,但是THLG‑EXO/5‑FU/miR‑21i对细胞增殖的抑制作用更强,几乎完全抑制了细胞的增殖。而用THLG‑EXO/miR‑21i处理的细胞增殖略有下降。这与作者在细胞周期阻断和凋亡结果上的发现一致。因此,研究结果揭示了miR‑21i可以提高HCT-1165FR细胞对5-FU的敏感性,并且与单药剂治疗相比,5-FU与miR-21i联合治疗可以显著提高5-FU对HCT-1165FR细胞的抗肿瘤作用。
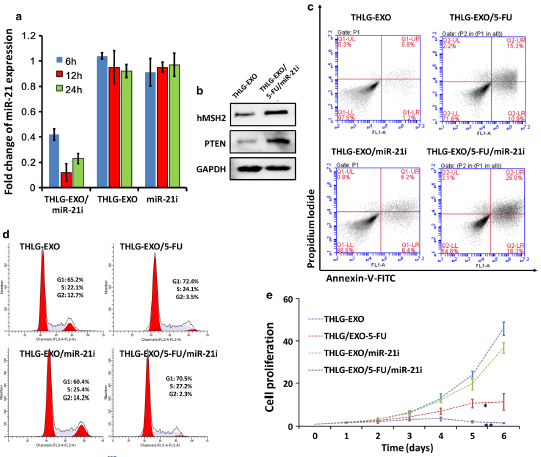
Fig.3 用THLG‑EXO/5‑FU/miR‑21i体外处理HCT-1165FR细胞的结果
5.THLG‑EXO在体内的分布情况
THLG‑EXO介导的miR‑21i和5‑FU对Her2阳性癌细胞的共递送已显示理想的体外递送效果。随后,作者用体内成像系统评估其体内递送效率。为了阐述体内靶向肿瘤的能力,作者在BALB/c雌性裸鼠的皮下接种了HCT-1165FR细胞。之后,用DiR染料标记THLG‑EXO和LG‑EXO,经尾静脉注射入裸鼠体内。在不同的时间点监测注射的外泌体的生物分布情况。如Fig.4所示,在注射后的最早时间点(30min),THLG‑EXO和LG‑EXO迅速分布全身,不同的是,THLG‑EXO在肿瘤内分布比较多,说明THLG‑EXO在肿瘤区域内能快速积累,而LG‑EXO主要分布在肝脏,这表明了LG‑EXO吸收和保留主要发生在肝脏和其他代谢器官,没有在肿瘤区域积累。此外,随着时间的推移,在这两组之间发现了显著的差异。在注射THLG‑EXO 3小时后,肿瘤区域能检测到较强的荧光信号,而小鼠身体其他部位的英冠光信号逐渐减弱。此外,在注射LG‑EXO 6小时后,足部和颈部仍可检测到相对强烈的荧光信号。相比之下,THLG‑EXO组在这些部位没有检测到信号,而荧光信号仅在肿瘤部位检测到了。综上所述,这些数据表明THLG‑EXO可以作为靶向Her2表达肿瘤细胞的有效药物载体。
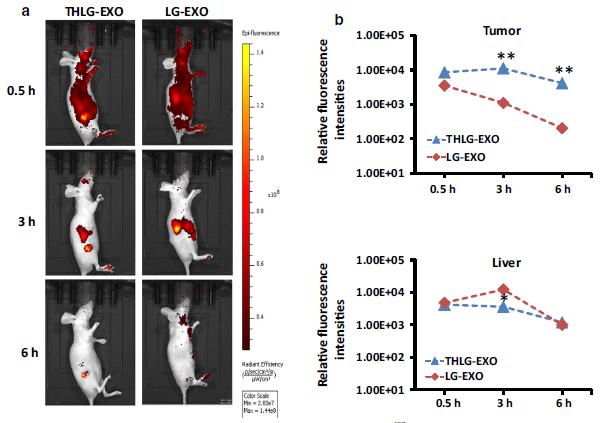
Fig.4 用HCT-1165FR细胞接种到裸鼠里观察THLG‑EXO的肿瘤靶向能力
6.THLG‑EXO/5‑FU/miR‑21i的体内抗肿瘤作用
体外实验显示THLG‑EXO具有高效靶向肿瘤细胞给药的能力,以及miRNA调控与5-FU治疗的协同作用,随后作者也在体内用这种多组合方法评估是否能增强抗肿瘤作用。作者将HCT-1165FR-Luc诱导的肿瘤雌性裸鼠随机分成四组并给予注射药物制剂,包括THLG‑EXO/5‑FU/miR‑21i、THLG‑EXO/5‑FU、THLG‑EXO/miR‑21i及THLG‑EXO对照组。作者用肿瘤部位的生物荧光强度估计肿瘤大小。与预期一样,THLG-EXO/5-FU/miR-21i组效果最佳,即肿瘤体积随时间显著缩小。如Fig.5a所示,其他的治疗仍有不同程度的肿瘤扩大,尤其是THLG-EXO组,恶性肿瘤转移比较明显。通过测量相对发光强度,定量各组小鼠的平均发光强度(BLI)(Fig.5b)。在研究结束时,处死小鼠,切除肿瘤并称重。如Fig.5c所示,显然,与注射THLG-EXO和THLG-EXO/5-FU的小鼠相比,注射THLG-EXO/5-FU/miR-21i的小鼠肿瘤生长明显受到抑制,肿瘤重量下降。
为了进一步评估不同外泌体在肿瘤中诱导的细胞凋亡情况,作者采用TdTdUTP标记(TUNEL)染色分析细胞凋亡。如Fig.5d所示,静脉注射THLG-EXO/5-FU或THLG-EXO/5-FU/miR-21i后,TUNEL阳性细胞数量明显增加,其中THLG-EXO/5-FU/miR-21i组尤为明显。静脉注射THLG-EXO/miR-21i后,TUNEL阳性细胞数略有增加,表明了仅使用miR-21i对细胞凋亡影响不大。然而,工程化外泌体同时结合miR-21i和5-FU可以得到非常显著的抗肿瘤作用。随后,作者通过WB检测了外泌体传递的miR-21i的基因调控活性。如Fig.5e所示,THLG-EXO/miR-21i和THLG-EXO/5-FU/miR-21i能提升肿瘤组织中hMSH2和PTEN的蛋白表达,而THLG-EXO单独递送5-FU对hMSH2和PTEN的表达几乎没有明显的影响。这些体内的实验结果与细胞内的体外实验结果呈正相关,并且发现THLG-EXO介导5-FU和miR-21i共递送,对肿瘤的作用效果最好。
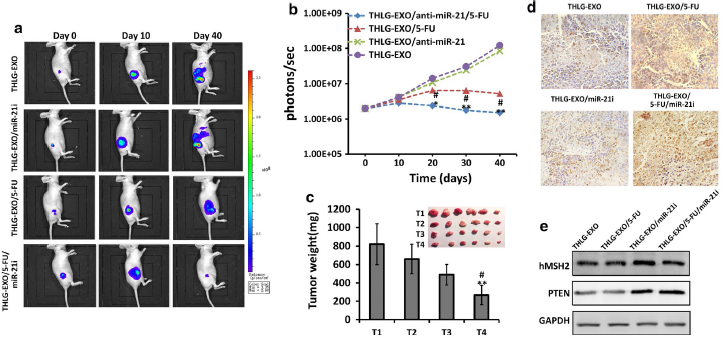
Fig.5 HCT-1165FR-Luc异种移植到裸鼠里研究THLG-EXO/5-FU/miR-21i抗肿瘤活性
7.体内的安全性评估
除了治疗效果,毒性是一个优良载体进一步使用需要考虑的另一个关键参数。出于安全考虑,作者每隔一天静脉注射20mg/kg 剂量的THLG-EXO,持续一周后评估THLG-EXO是否对健康BALB/c小鼠的全身系统产生毒性。与PBS组相比,实验组在研究期间没有观察到小鼠的死亡和严重的体重下降(数据未显示)。众所周知,经静脉注射的纳米级脂泡大部分被单核吞噬细胞系统(MPS)吸收和清除。因此,作者进一步研究了外泌体对这些器官诱发的潜在病理损伤。用血液生化和血液学分析外泌体对处理小鼠的任何潜在毒性作用。作者检测了不同生化指标,包括肝功能指标如谷丙转氨酶(ALT)、天冬氨酸转氨酶(AST),肾功能指标如肌酐(CRE)、血尿素氮(BUN)。从表1中可以看出,上述各项指标均与PBS处理组相同,说明THLG-EXO在给药方案中没有明显的肝或肾毒性。血液学检查包括白细胞(WBC)、红细胞(RBC)和血小板计数。上述参数中THLG-EXO处理组与PBS组比较均无显著性差异(Table 1)。此外,如Fig.6所示,在THLG-EXO处理组中心脏、肝脏、脾脏、肺、肾等主要组织未见明显的组织病理学异常或病变,这说明了THLG-EXO没有引起炎症反应。这些结果表明,THLG-EXO多次给药对小鼠血液系统和主要器官不会引起急性毒性。
Table 1 THLG-EXO处理组小鼠的临床化学和血液学参数

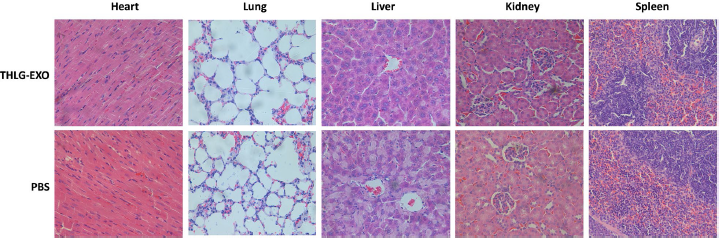
Fig.6 THLG-EXO的系统毒性评价
结论:
在本篇研究中,作者成功开发了一种联合策略,利用工程化外泌体的传递系统,同时将miR-21i和化疗药物5-FU传递给HCT-1165FR癌细胞,有效逆转了耐药性,提高了肿瘤治疗的作用。
和元生物一直致力为外泌体研究提供整体解决方案,从实验设计、外泌体分离、外泌体鉴定、外泌体分子检测到外泌体示踪和体内外功能验证,丰富的项目经验、专业的科研团队、优质的技术支持服务,为您的项目保驾护航!
参考文献:
[1] Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68:7–30.
[2] Krishna R, Mayer LD. Multidrug resistance (MDR) in cancer. Mechanisms, reversal using modulators of MDR and the role of MDR modulators in influencing the pharmacokinetics
[3] Wang S, Su X, Bai H, Zhao J, Duan J, An T, Zhuo M, Wang Z, Wu M, Li Z, et al. Identification of plasma microRNA profiles for primary resistance to EGFR-TKIs in advanced non-small cell lung cancer (NSCLC) patients with EGFR activating mutation. J HematolOncol. 2015;8:127.
[4] Alvarez-Erviti L, Seow Y, Yin H, Betts C, Lakhal S, Wood MJA. Delivery of siRNA to the mouse brain by systemic injection of targeted exosomes. Nat Biotechnol. 2011;29:U341–U179.
[5] Valeri N, Gasparini P, Braconi C, Paone A, Lovat F, Fabbri M, Sumani KM, Alder H, Amadori D, Patel T, et al. MicroRNA-21 induces resistance to 5-fluorouracil by down-regulating human DNA MutS homolog 2 (hMSH2). Proc Natl AcadSci USA. 2010;107:21098–103.
[6] Thery C, Zitvogel L, Amigorena S. Exosomes: composition, biogenesis and function. Nat Rev Immunol. 2002;2:569–79.
[7] Yang T, Martin P, Fogarty B, Brown A, Schurman K, Phipps R, Yin VP, Lockman P, Bai S. Exosome delivered anticancer drugs across the blood-brain barrier for brain cancer therapy in Danio rerio. Pharm Res. 2015;32:2003–144.
[8] Gaofeng Liang, Yanliang Zhu, DoulathunnisaJaffar Ali, Tian Tian, Huantian Xu, et al. Engineered exosomes for targeted co-delivery of miR-21 inhibitor and chemotherapeutics to reverse drug resistance in colon cancer. J Nanobiotechnology. 2020;18.
