21世纪以来,人们对补体的认识从基于血液的抗菌素系统转变为免疫和组织稳态的全局调节器。近年来,对补体激活机制、结构、功能方面取得的显著的进展,为补体生物学增添了新的复杂性。这种复杂性反映在广泛的炎症、神经退行性疾病和癌症中,补体以网络形式影响免疫和疾病发病机制。
补体系统及补体的三条激活途径
补体系统,也称为补体级联反应,是天然免疫系统的重要组成部分,在防御微生物感染和清除免疫复合物和受伤的细胞过程中担当着至关重要的作用。在正常情况下,补体是由一些体液和细胞表面蛋白严格控制的,以避免对自体组织的损伤。在自身免疫性疾病或调节蛋白功能失调的受试者中,当补体过度激活时,会在许多器官中引发严重的炎症反应。
补体固有成分可分为4类:① 经典激活途径的C1、C2、C4;② 旁路激活途径的B因子、D因子和P因子;③ 甘露聚糖结合凝集素(MBL)激活途径的MBL和丝氨酸蛋白酶;④ 参与共同末端通路的C3、C5、C6、C7、C8、C9。目前已知补体系统是由30余种可溶性蛋白、膜结合蛋白和补体受体组成,广泛分布在循环和组织中,它们在各种刺激下由许多细胞合成和分泌,包括细胞因子和激素。
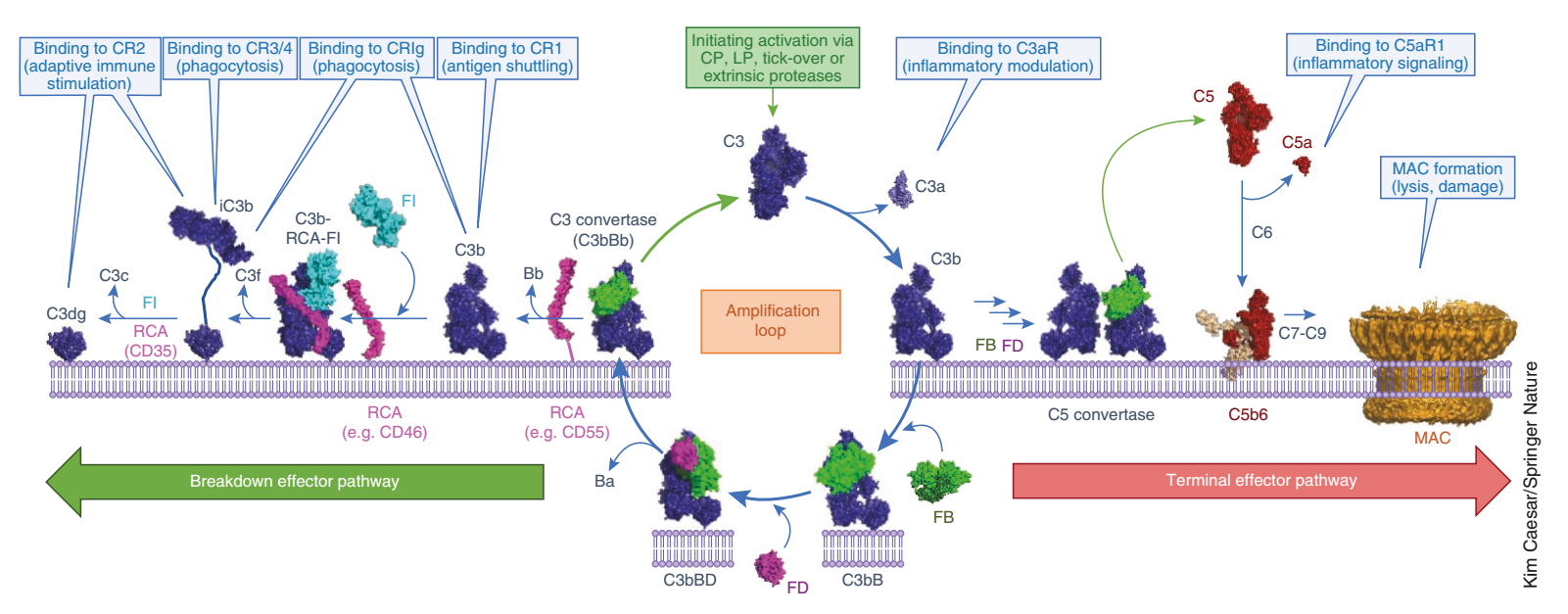
C3介导的补体激活、扩增及效应分子产生的分子机制
尽管缺乏获得性免疫系统组成部分的特异性,补体以经典途径、凝集素途径和旁路激活途径三条激活途径,实现选择性地识别外来病原体和受损的自身细胞。
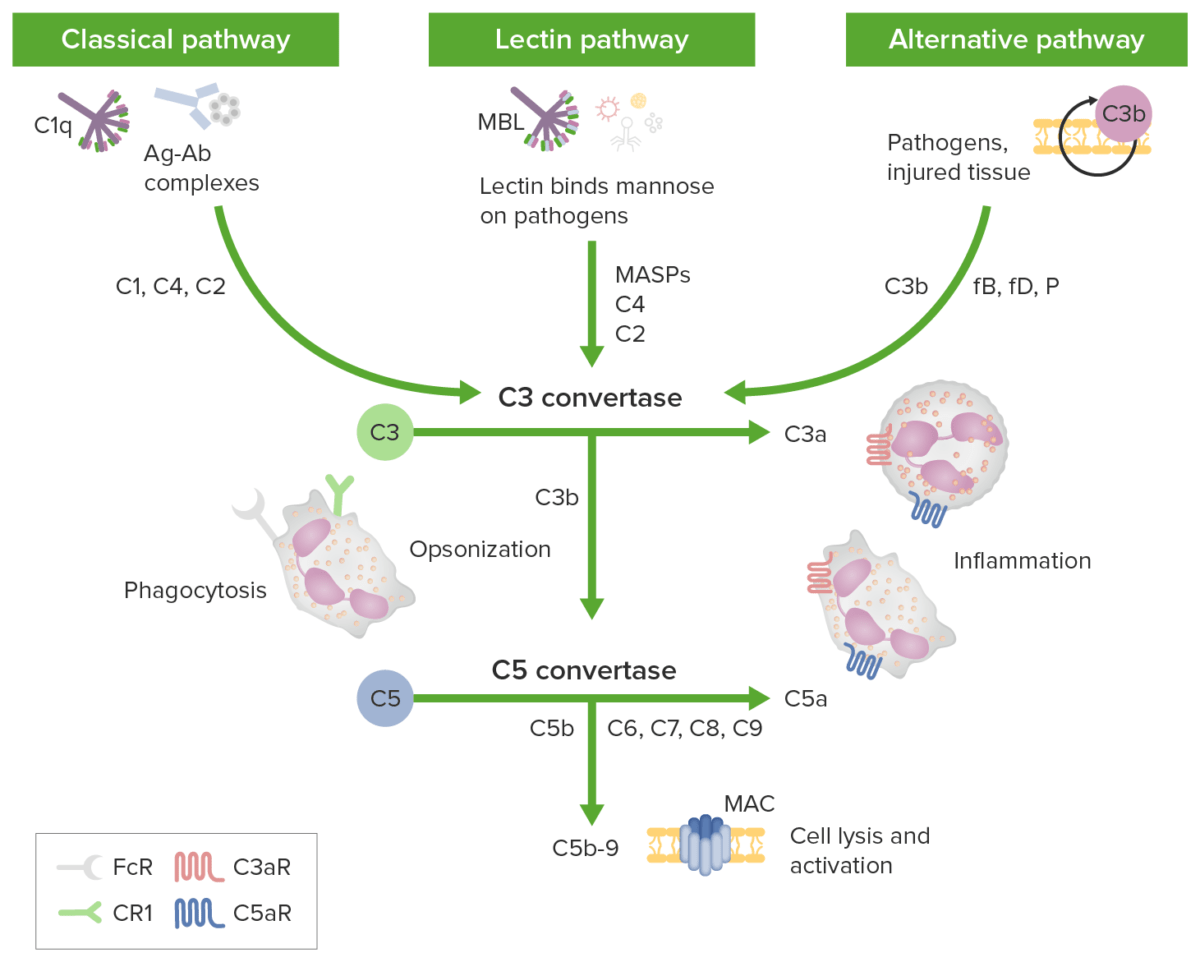
补体级联的三条激活途径
1.经典途径(classic pathway)由抗原-抗体复合物触发,非激活的C1 作为血清分子复合物循环,包括六个 C1q 分子和两个丝氨酸蛋白酶分子 C1r 和 C1s。在与同源抗原结合后,IgG或IgM抗体的Fc片段与C1q的胶原状尾部相互作用。这种相互作用导致构象变化以及C1r、C1s、C4、C2、C3的依次活化,形成C3转化酶(C4b 2b)与C5转化酶(C4b2b3b)的级联酶促反应过程。
2.凝集素途径(MBL pathway)通过甘露聚糖结合凝集素(mannan binding lectin, MBL)糖基识别,下游效应与经典途径相同。
3.旁路途径(alternative pathway)触发机制同样不依赖于抗体,由B因子、D因子和P因子参与,直接由微生物或外源异物激活C3,形成C3与C5转化酶,激活补体级联酶促反应的活化。上述三条补体途径具有共同的末端通路:C5在C5转化酶的作用下可以裂解成C5a和C5b。C5a因子是急性感染、组织损伤炎症早期出现的最强因子,被公认为是广谱炎性放大器;C5b可以与补体蛋白C6、C7、C8和C9形成膜攻击复合物(MAC/membrane attack complex,C5b-9),直接溶解靶向病原体或受损的自身细胞。
补体在炎症中的作用
补体作为先天免疫系统的一部分,在个人的一生中不具有适应性,在早期发育中具有稳态重要性,但在老化的免疫系统中异常地重新激活,因此,补体是包括衰老相关疾病在内的病理炎症过程的关键贡献者。
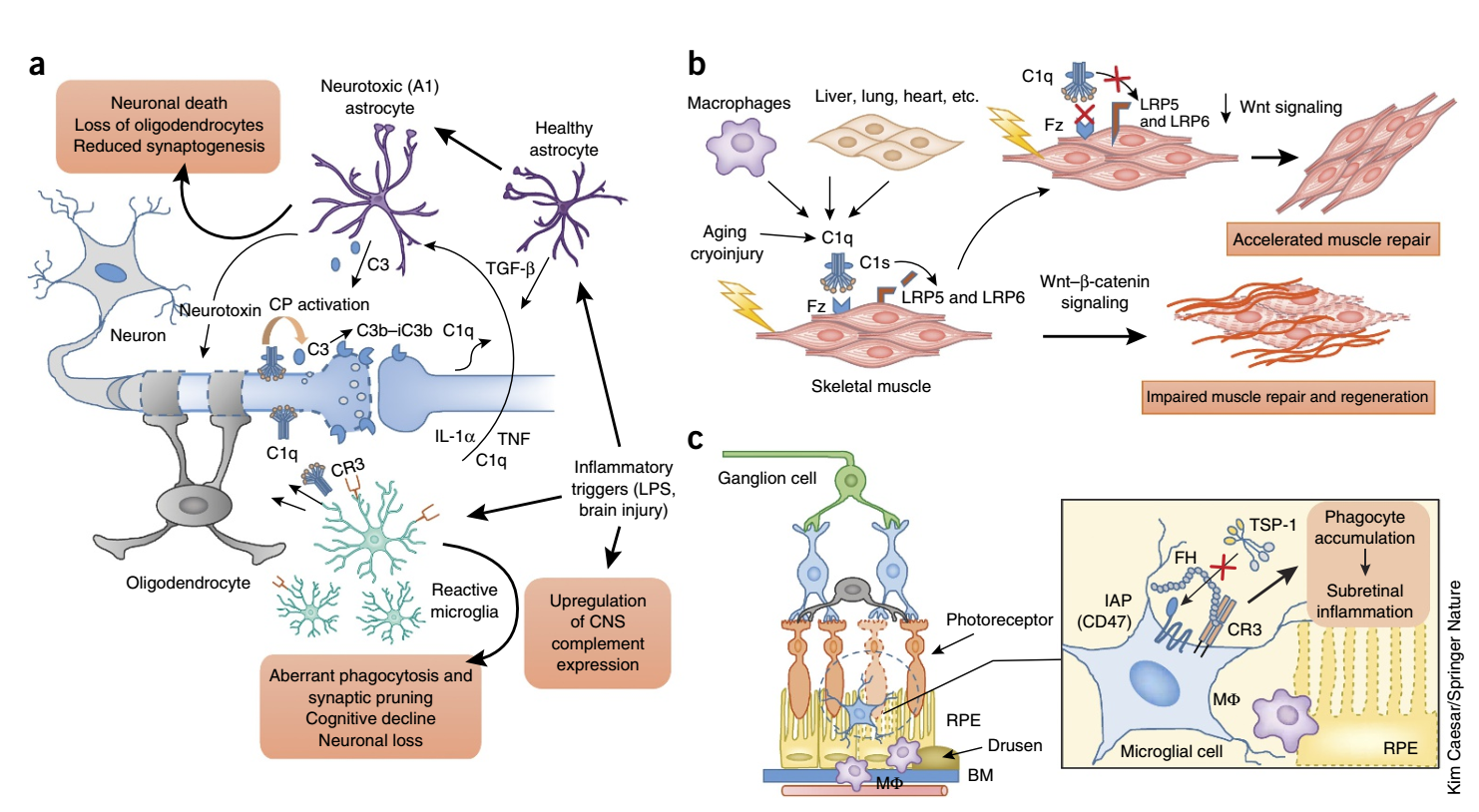
有研究揭示,补体驱动和参与了慢性和衰老相关的炎症状况,从皮肤、肾脏和眼部疾病到神经炎症和神经退行性疾病。◆ 难治性癫痫患者皮质中C1q和C3的富集与异常小胶质细胞活动标记物相关,这表明抑制性突触的丢失可能是人类癫痫中观察到的神经元超兴奋性的原因。◆ 阿尔茨海默病(AD)是全球范围内年龄相关性痴呆的主要病因,其标志是星形胶质细胞和小胶质细胞的强烈激活以及淀粉样β斑块和缠结上补体的沉积。早期补体成分(C1q和C3)与淀粉样原纤维的吞噬清除有关,而晚期补体效应物(C5a和MAC)与炎症神经元损伤有关。与此相一致的是,在AD的各种转基因模型中,靶向治疗C5aR1可改善病理指标。此外,在年龄相关性AD病理的转基因模型中,C3缺乏可减轻突触损失和认知能力下降。◆ 年龄相关性黄斑变性(AMD)是一种常见的眼部炎症性疾病,是世界范围内老年人失明的主要原因。全基因组关联研究已经确定FH的多态性是AMD的关键易感性因素。FH与CR3的结合已被证明可以抑制血小板反应蛋白-1对整合素相关受体CD47的激活,而后者是视网膜下吞噬细胞稳态消除所必需的。AMD相关的FH变体H402Y增强了这种抑制作用,从而导致视网膜下吞噬细胞的病理积累。
补体在癌症中的作用
补体通过调节炎症、T细胞免疫和血管化,以及肿瘤细胞的增殖、迁移和侵袭能力,在决定肿瘤生长中发挥关键作用。肿瘤微环境补体的不平衡激活触发肿瘤细胞和肿瘤浸润免疫细胞释放促炎细胞因子,局部炎症抑制了效应T细胞的激活,创造了有利于肿瘤生长的环境。补体激活产物,特别是C5a,促进血管生成,从而促进肿瘤细胞的迁移和邻近组织的侵袭和转移。
补体已被证明可以调节骨髓源性抑制细胞向肿瘤部位的分化和募集。对黑色素瘤、肠道、宫颈癌和肺癌动物模型的研究表明,C3aR-和C5ar1介导的通路通过先天免疫细胞的激活和极化、促肿瘤因子的释放和效应T细胞的抑制,形成促肿瘤环境。
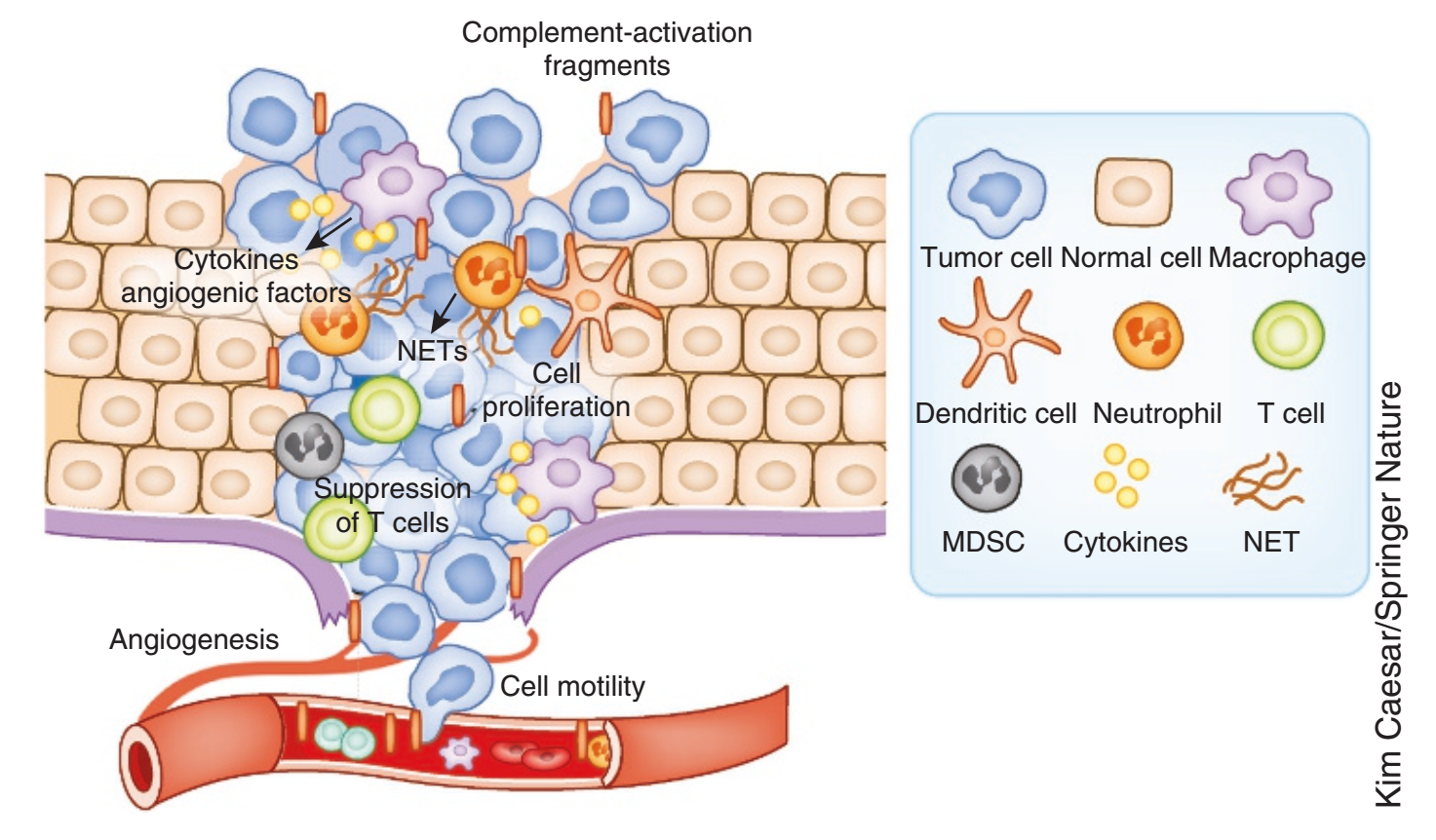
补体在癌症中的作用
在黑色素瘤和肺癌模型中,补体和PD-L1联合阻断比单独治疗更有效地减弱肿瘤发生,这为探索补体抑制联合特异性免疫疗法以激活患者自身抗癌免疫开辟了新途径。此外,临床使用的各种治疗癌症的单克隆抗体具有激活肿瘤细胞表面补体的功能,从而增强其杀伤和消除作用。
补体在COVID-19中的作用
补体是针对病毒激发固有免疫反应和促炎反应的组成部分。与SARS-CoV-2密切相关的研究发现,补体成分C3的激活可加剧急性呼吸窘迫综合征(ARDS),C3抑制也可能减轻SARS-CoV-2感染的炎性肺部并发症。C3抑制可同时阻断C3a和C5a生成,肺泡巨噬细胞或其他表达C3a受体(C3aRs)和/或C5a受体(C5aRs)的细胞肺内C3激活和IL-6释放,从而改善肺损伤,同时暗示了C3抑制剂与抗IL -6方案联合的可能性。严重COVID-19患者的肺活检样本显示广泛的补体激活,特征为C3a生成和C3碎片沉积,C5a血清水平显著增加,而使用抗C5a抗体的治疗患者立即得到临床改善。
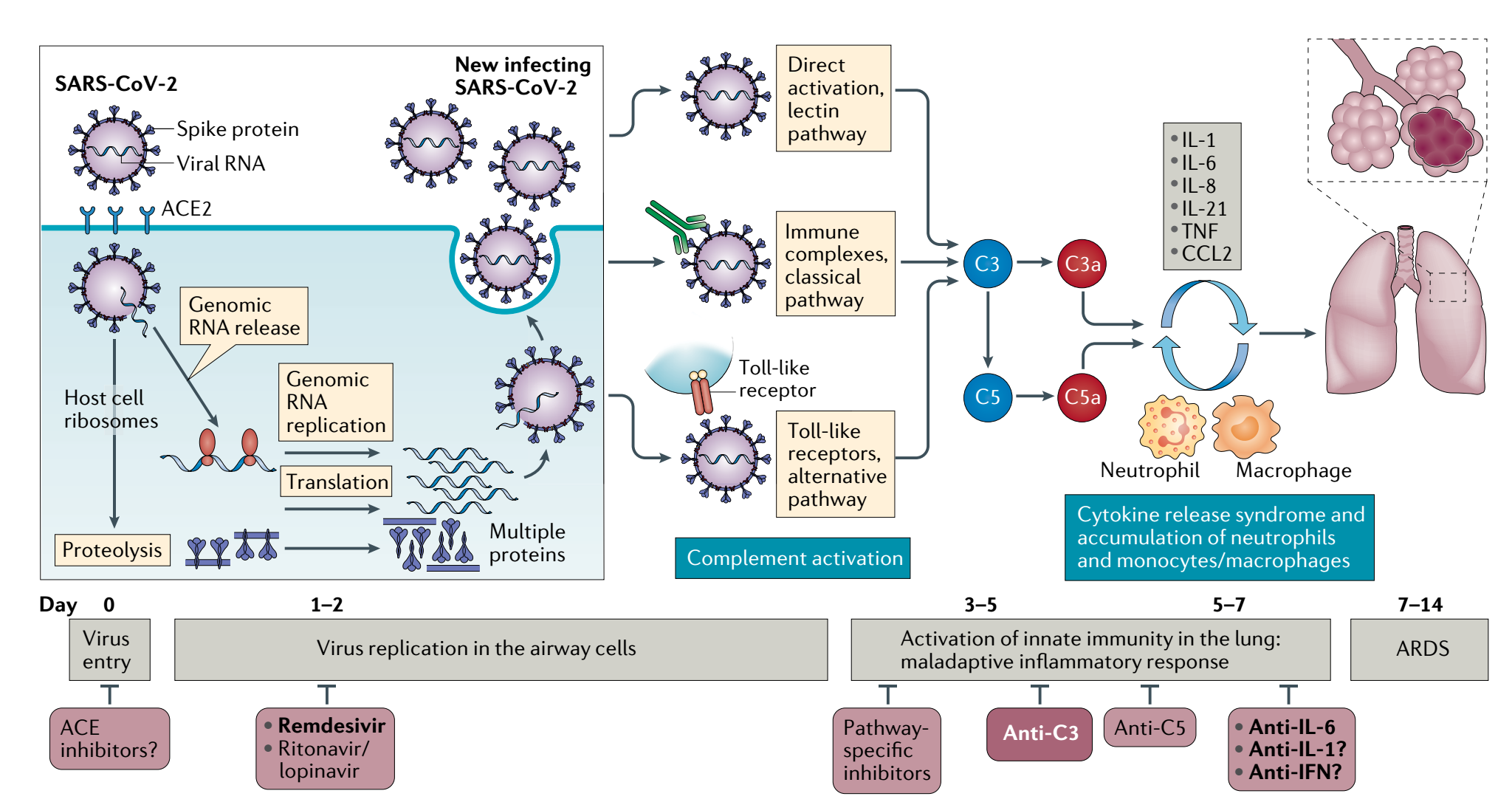
靶向补体在SARS-CoV-2相关肺损伤中的作用
补体激活可能导致一些重症COVID-19患者出现适应性不良的炎症反应。在这些严重的COVID-19中,C3 抑制有可能广泛应用于不仅控制 ARDS,还控制肾脏、大脑微血管床和其他重要器官全身炎症。因此,抑制C3或C5可能具有治疗潜力。
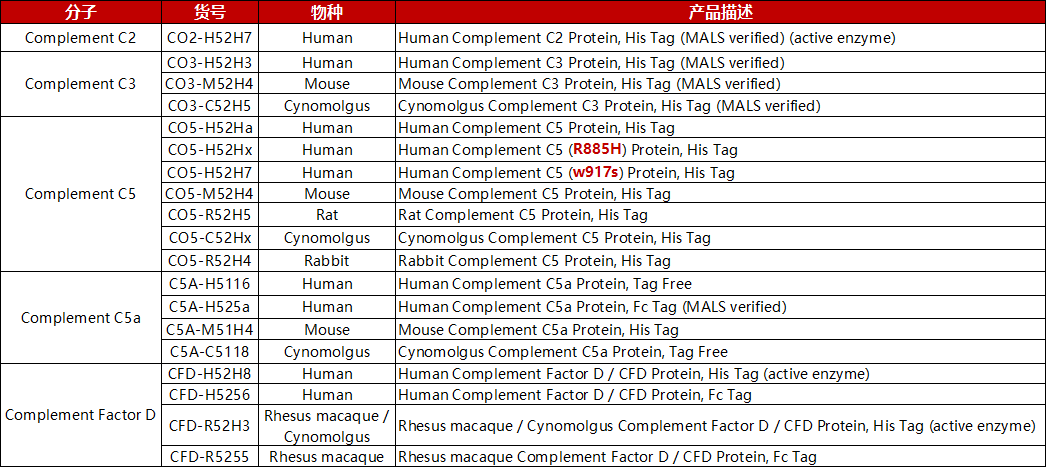
更加充分了解补体的结构、功能和生物学作用将支持我们基于补体的认识为治疗炎症、神经退行性疾病、癌症和COVID-19做出贡献。ACROBiosystems开发了一系列HEK293表达的补体蛋白,包括C2,C3,C5(包括突变型),C5a和补体因子D(CFD),种属覆盖更全面,高纯度经SDS-PAGE验证,均一的确定的结构经MALS验证,高生物活性经ELISA和细胞水平实验验证。
产品列表
部分验证数据
★纯度>95%(SDS-PAGE)

Human Complement C3, His Tag (Cat. No.CO3-H52H3) 的理论分子量为 186.8 kDa,由于糖基化影响,在还原条件SDS-PAGE下迁移为 70 kDa、100-120 kDa 和160-180 kDa,纯度高于95%。经SEC-MALS验证,Human Complement C3, His Tag (Cat. No. CO3-H52H3) 的结构均一度高于90%, 分子量为168-204 kDa。
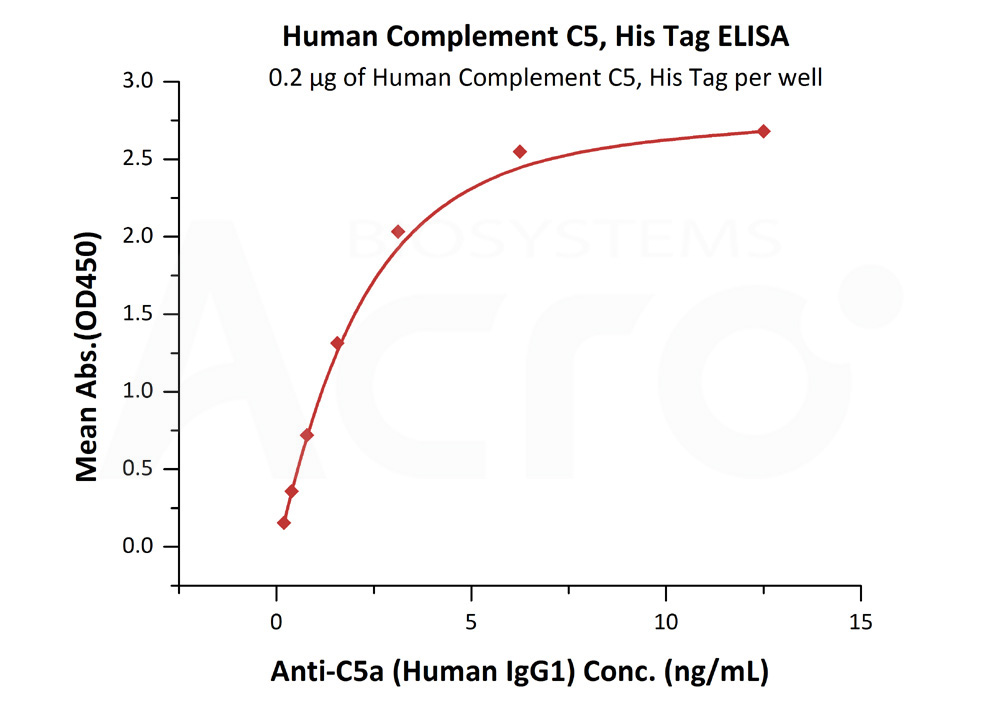
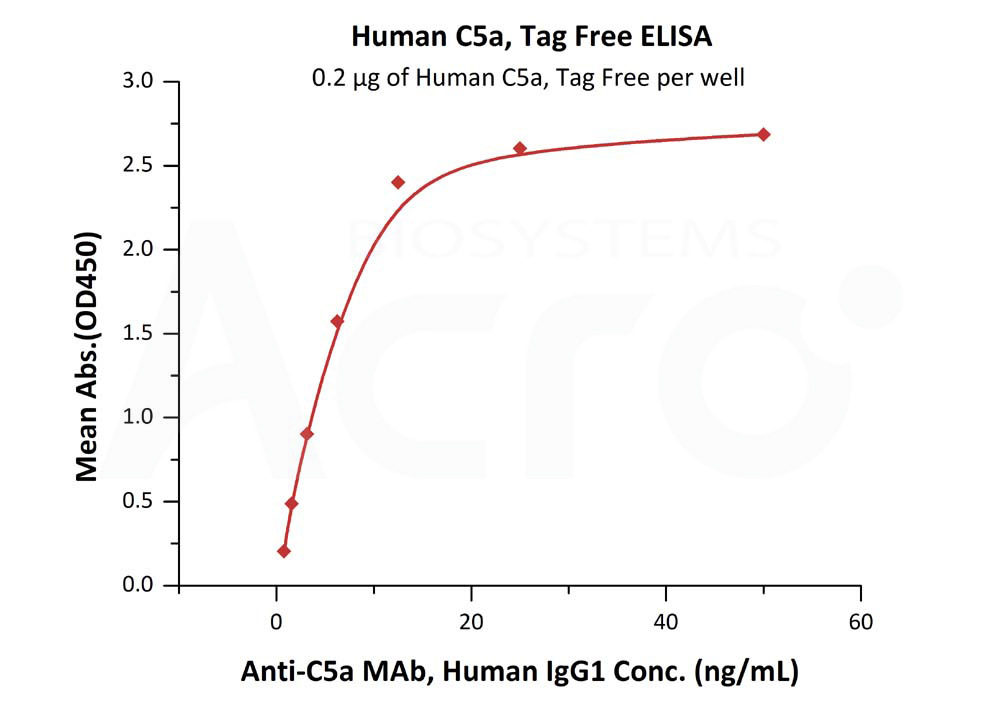
★高生物活性经ELISA验证(QC检测)
Human Complement C5, His Tag (Cat. No. CO5-H52Ha)可特异性结合Anti-C5a抗体(Human IgG1),线性区间为0.2-3 ng/mL。
Human Complement C5a, Tag Free (Cat. No. C5A-H5116) 可特异性结合Anti-C5a抗体(Human IgG1),线性区间0.8-13 ng/mL。
★高生物活性经细胞水平实验验证
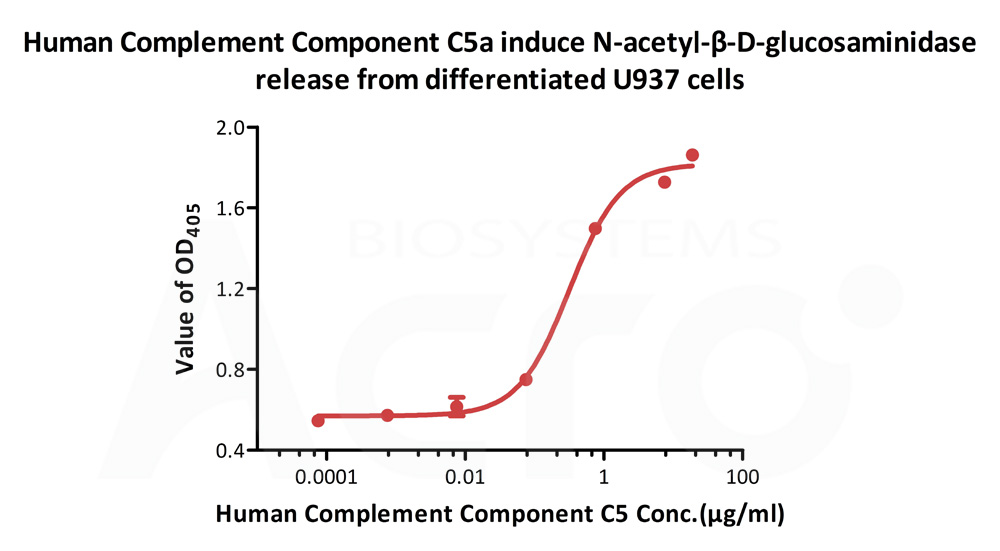
Human Complement C5a,Tag Free (Cat. No. C5A-H5116) 可诱导分化的U937 细胞释放 N-乙酰基-β-D-氨基葡萄糖苷酶,ED50 为 0.215-0.323 μg/mL。
ACROBiosystems秉承“从靶点蛋白开始,为更好生物医药” 的理念,开发了一系列包括白细胞介素(Interleukins)、生长因子(Growth Factors)、肿瘤坏死因子(TNFs)、趋化因子(Chemokines)、集落刺激因子(CSFs)、干扰素(IFNs)、补体因子等重组细胞因子及其受体蛋白产品,满足您的药物开发需求,与您共创靶向细胞因子的药物开发新篇章。

ACROBiosystems
inquiry@acrobiosystems.com
15117918562
(备注:姓名+公司)
参考文献
1、Hajishengallis, G., Reis, E., Mastellos, D.
et al. Novelmechanisms and functions of complement.
Nat Immunol 18
, 1288–1298(2017).
https://doi.org/10.1038/ni.38582、
https://www.lecturio.com/concepts/innate-immune-response/3、 Marina Noris,Giuseppe Remuzzi, Overview of Complement Activation and Regulation,
Seminarsin Nephrology(2013)
.
https://doi.org/10.1016/j.semnephrol.2013.08.001.4、 Risitano, A.M., Mastellos, D.C., Huber-Lang, M.
et al. Complementas a target in COVID-19?.
Nat Rev Immunol 20
, 343–344(2020).
https://doi.org/10.1038/s41577-020-0320-7